
【题目】下列叙述中正确的有
①![]() 该原子的电子排布图,最外层违背了洪特规则
该原子的电子排布图,最外层违背了洪特规则
②处于最低能量状态原子叫基态原子,1s22s22px1→1s22s22py1过程中形成的是发射光谱
③运用价层电子对互斥理论,CO32-离子的空间构型为三角锥型
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
A.1个
B.2个
C.3个
D.4个
科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为
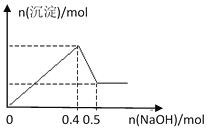
A. 1:3B. 1:6
C. 2:3D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种环境激素,存在如图转化关系:
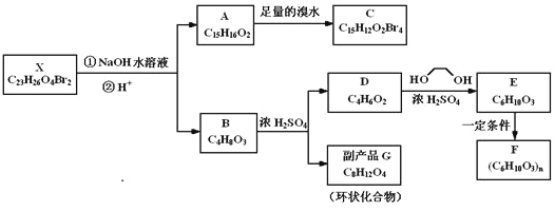
化合物A能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。1H﹣NMR谱显示化合物G的所有氢原子化学环境相同。F是一种可用于制备隐形眼镜的高聚物。根据以上信息回答下列问题:
(1)下列叙述正确的是__;
a.化合物A分子中含有联苯结构单元
b.化合物A可以和NaHCO3溶液反应,放出CO2气体
c.X与NaOH溶液反应,理论上1mol X最多消耗6mol NaOH
d.化合物D能与Br2发生加成反应
(2)化合物C的结构简式是__,A→C的反应类型是__;
(3)写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构)__;
a.属于酯类 b.能发生银镜反应
(4)写出B→G反应的化学方程式__;
(5)写出E→F反应的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2]。下列有关说法正确的是( )

A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 除去尿素的反应为:CO(NH2)2+2Cl2+H2O== N2+CO2+4HCl
D. 若两极共收集到气体0.6mol,则除去的尿素为0.12mol(忽略气体溶解,假设氯气全部参与反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示。下列说法不正确的是
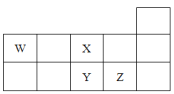
A. Z、Y、X的原子半径依次减小,非金属性依次降低
B. Z、Y、W的最高价氧化物的水化物的酸性依次降低
C. WH4与Z元素的单质在一定条件下可发生化学反应
D. W的位置是第2周期,第IV A族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是元素周期表的一部分,参照①~⑧元素在表中的位置,请用化学用语回答下列问题:
周期/主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)④、⑤、⑧三种元素中,离子半径大小的顺序为__________(填离子符号)。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_________(填化学式)。
(3)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为:_____________。
(4)能说明⑧的非金属性比⑨的非金属性_________(填“强”或“弱”)的事实是____________________________(用离子方程式说明)。
(5)①和③形成的18电子的化合物甲是一种应用广泛的化工原料,写出甲的电子式:_________,实验室中可用次氯酸钠溶液与氨反应制备甲,反应的化学方程式为:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(V)为过渡元素,可形成多价态化合物,在工业催化、新材料、新能源等领域有广泛应用。
(1)金属钒熔点很高,可由铝热反应制得。
已知25℃、101 KPa时
4A1(s)+3O2(g)═2Al2O3(s)△H1=akJmol-1
4V(s)+5O2(g)═2V2O5(s)△H2=bkJmol-1
则用铝热反应冶炼金属V(s)的热化学方程式为______。
(2)全钒液流电池是一种新型的绿色环保储能系统,工作原理如图所示:
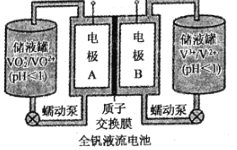
查阅相关资料可知:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
①该电池放电时,VO2+发生还原反应,则正极的反应式是______。
②当完成储能时,负极溶液的颜色为______。
③电池放电时,负极区溶液的pH将______(填“增大”、“减小”或“不变”)。
④用该钒电池在铁制品上镀铜,铁制品应与电池的______极(填“A“或“B“)相连。若电镀开始时两电极质量相等,电镀一段时间后,两电极质量之差为128g,此时转移电子的物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积Kw | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a__1×10-14(填“>”“<”或“=”)。
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1 mL加水稀释至10mL,则稀释后溶液中c(Na+)∶c(OH-)=__。
(3)在t2℃下pH=10的NaOH溶液中,水电离产生的OH-浓度c(OH-)水=__。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)造成酸雨、光化学烟雾、臭氧层破坏等危害,不仅破坏自然生态环境,而且严重危害人类健康。采用合适的还原剂能够实现烟气的高效脱硝。
(1)活性炭还原脱硝可防止氮氧化物污染,已知:
①N2(g)+O2(g)═2NO(g) △H1=+180.5kJmol-1
②2C(s)+O2(g)═2CO(g) △H2=-221.0kJmol-1
③2CO(g)+O2(g)═2CO2(g) △H3=-556.0kJmol-1
则反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H=__kJmol-1
N2(g)+CO2(g)△H=__kJmol-1
(2)用活性炭对NO进行还原,采用相同质量不同粒径的同种催化剂M和N,测量相同时间内烟气的脱氮率,结果如图所示。
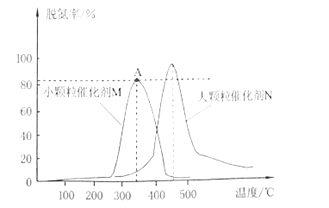
①在M、N两种不同粒径催化剂作用下,出现M和N两条不同的脱氮率与温度的变化曲线的原因是___。
②判断M曲线上最高点A点对应的脱氮率__(填“是“或“不是”)该温度下的平衡脱氮率。
③25℃下,用NaOH溶液作捕提剂吸收产生的CO2,不仅可以降低碳排放,而且可得到重要的化工产品。某次捕捉后得到pH=12的溶液,已知:25℃下Ka2(H2CO3)=5.6×10-11,试通过计算溶液中c(CO32-):c(HCO3-)=__。
(3)在一恒容密闭容器中,使用某种催化剂对反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)△H<0进行相关实验探究。改变投料比(n0(SO2):n0(NO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定SO2的平衡转化率[α(SO2)]。已知:KR=16,KZ=1,部分实验结果如图所示。
SO3(g)+NO(g)△H<0进行相关实验探究。改变投料比(n0(SO2):n0(NO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定SO2的平衡转化率[α(SO2)]。已知:KR=16,KZ=1,部分实验结果如图所示。
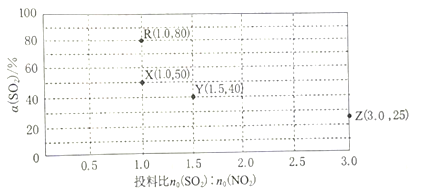
①如果要将图中R点的平衡状态改变为X点的平衡状态,应采取的措施是__。
②图中R、X、Y、Z四点对应的实验温度分别为TR、TX、TY,TZ通过计算选择下列选项中两个温度相等是__(填标号)。
A.TR和TY B.TR和TZ C.TX和TZ D.TY和TZ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com