
已知N2 (g) + 3H2(g) 2NH3(g) (正反应放热),工业合成氨采用在500℃的条件下进行的原因是
① 只有在此温度下反应才能发生 ② 升高温度有利于NH3的合成
③ 提高反应速率,以提高单位时间内NH3的产量 ④ 使催化剂达到最佳催化活性
A.③④ B.①② C.①③ D.②④
科目:高中化学 来源: 题型:
在一定温度下,向容积不变的容器中加入2 mol N2、8 mol H2 及固体催化剂,使之反应.已知:N2(g)+3H2(g)![]() 2NH3(g);△H=-92.2kJ·mol-1.平衡时,容器内气体压强为起始时的80%.
2NH3(g);△H=-92.2kJ·mol-1.平衡时,容器内气体压强为起始时的80%.
(1)反应达到平衡时,放出的热量_______.
A.小于92.2 kJ B.等于92.2 kJ C.大于92.2kJ
(2)欲使H2的转化率提高为原来的两倍,则在其他条件不变的情况下,应将N2的初始量由2mol提高至__________mol.
(3)保持同一温度,在相同的容器中,若起始时加入2molNH3、1molH2 及固体催化剂,反应达到平衡时NH3的体积分数_________.
A.等于0.25 B.大于0.25 C.小于0.25
(4)右图是T1℃时容器中NH3的物质的量随时间的变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时n(NH3)的变化曲线.
查看答案和解析>>
科目:高中化学 来源:2010—2011年江苏盐城中学高二上学期期末考试化学卷(选修) 题型:填空题
(6分,每空2分)在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热量。已知0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量。
(1)写出肼和双氧水反应的热化学方程式_________ _______________。
(2)已知H2O(l)==H2O(g);△H=+44KJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是______ _______。
(3)已知N2(g) + 2O2(g) ="=" 2NO2(g);△H=+67.7KJ/mol,
N2H4(g) + O2(g) ="=" N2(g)+2H2O(g);△H= —534KJ/mol,
则肼与NO2完全反应的热化学方程式为_____ _____________________。
查看答案和解析>>
科目:高中化学 来源:2012—2013学年中大附中三水实验学校高二上期中文科化学试卷(带解析) 题型:单选题
已知N2(g)+3H2(g) 2NH3(g)。现向一密闭容器中充人1 mol N2和3 mol H2,在一定条件下使该反应发生。下列有关说法正确的是 ( )
2NH3(g)。现向一密闭容器中充人1 mol N2和3 mol H2,在一定条件下使该反应发生。下列有关说法正确的是 ( )
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,正反应和逆反应的速率都为零 |
| C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源:2011届海南省海口市高三高考调研测试地化学试卷 题型:填空题
(8分)下图是氨氧燃料电池示意图,按照此图的提示,回答下列问题: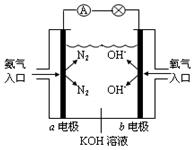
(1)a电极作______极(填“正”、“负”或“阴”、“阳”),其电极反应式为_________________;
(2)反应一段时间后,电解质溶液的PH将 (填“增大”、“减小”或“不变”);
(3)已知N2(g)+3H2(g)=2NH3(g) ΔH=" —92.4" kJ·mol-1;2H2(g)+O2(g)=2H2O(g) ΔH=" —483.6" kJ·mol-1,试写出氨气完全 燃烧生成气态水的热化学方程式:__________________________;
燃烧生成气态水的热化学方程式:__________________________;
(4)若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上97.5g锌,理论上至少需要消耗氨气_________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2013届贵州省高二上学期期中考试化学试卷 题型:计算题
(11分)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)====2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)=== N2(g)+2H2O (g);△H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com