
��A2+��B-��C2-��D��E��F��G��H�ֱ��ʾ����18�����ӵİ����������ӻ���ӣ�����ش�
��1��AԪ���� ��BԪ���� ��CԪ���� ����Ԫ�ط��ű�ʾ��
��2��D��������Ԫ����ɵ�˫ԭ�ӷ��ӣ������ʽ��
��3��E�����Ժ���18���ӵ���������������ǿ�ķ��ӣ������ʽ��
��4��F��������Ԫ����ɵ���ԭ�ӷ��ӣ������ʽ�� ����ʽ��
��5��G�����к���4��ԭ�ӣ������ʽ��
��6���ȷ����к��У���ԭ�ӣ������ʽ����������
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2009?����ģ�⣩A��B��C��D��E���ֶ�����Ԫ�أ�ԭ��������������A��Eͬ���壬AԪ�ص�ԭ�Ӱ뾶��С��BԪ��ԭ�ӵ��������������ڲ��������2����CԪ��ԭ�ӵĵ��Ӳ���Ϊn������������Ϊ2n+1��A��B��C��Eÿ��Ԫ�ض�����DԪ��������ֻ��������ϵij���������ش��������⣺
��2009?����ģ�⣩A��B��C��D��E���ֶ�����Ԫ�أ�ԭ��������������A��Eͬ���壬AԪ�ص�ԭ�Ӱ뾶��С��BԪ��ԭ�ӵ��������������ڲ��������2����CԪ��ԭ�ӵĵ��Ӳ���Ϊn������������Ϊ2n+1��A��B��C��Eÿ��Ԫ�ض�����DԪ��������ֻ��������ϵij���������ش��������⣺| 3 |
| 2 |
| 3 |
| 2 |
| 4 |
| a2 |
| 4 |
| a2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 4 |
| a2 |
| 4 |
| a2 |
| �� |
| �� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
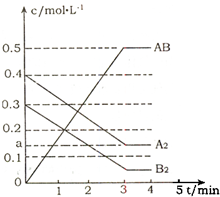 ��һ���ݻ�Ϊ2L���ܱ������м���0.8mol��A2�����0.6molB2���壬һ�������·������·�Ӧ��
��һ���ݻ�Ϊ2L���ܱ������м���0.8mol��A2�����0.6molB2���壬һ�������·������·�Ӧ��| c2(AB) |
| c(A2)��c(B2) |
| c2(AB) |
| c(A2)��c(B2) |
| 1 |
| 6 |
| 1 |
| 6 |
| c |
| 2 |
| c |
| 2 |
| c |
| 2 |
| c |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
A��B��C��D��E��F��G��H����Ԫ�طֲ���������ͬ�Ķ����ڣ����ǵ�ԭ������������������B��C��DΪͬһ���ڣ�A��E��B��G��D��H�ֱ�Ϊͬһ���壬C��D������������֮��Ϊ11��C��D��F����Ԫ�ص�ԭ������֮��Ϊ28����ش��������⣺
��1��B��D���γɷǼ��Է���X��������X��F D2����Һ��Ӧ�����ӷ���ʽΪ____________________________��
��2��E��F��H���γɵļ����ӵİ뾶�ɴ�С��˳��Ϊ�������ӷ��ű�ʾ�� ��
��3��G�������������B�ĵ����ڸ������ܷ����û���Ӧ���仯ѧ��Ӧ����ʽΪ��
��
��4����Y��B��D��E��ɡ���������YΪ����ʹ��ɵ�ȼ�ϵ������ͼ��ʾ��д��ʯī��I���缫�Ϸ����ĵ缫��Ӧʽ�� ��

��5����������Y��ȼ�ϵ������Դ����ʯīΪ�缫�����һ��Ũ�ȵ�CuSO4��Һ����ɫ��������һ��ʱ�䡣�Ͽ���·������Һ�м���0.1 mol Cu(OH)2����Һ�ָ������֮ǰ�������Ũ�ȣ����������ת�Ƶ��ӵ����ʵ���Ϊ______��
��6����A��C��D��E����Ԫ�����������ֹ��ɵ�ǿ�����Z��W������ˮʱ���ܴٽ�ˮ�ĵ��룬���Z��ˮ��ҺpH��7��W��ˮ��ҺpH��7����ZΪ ��WΪ ��
��7����һ��װ�п��ƶ������������н������·�Ӧ��C2(g)��3A2(g)![]() 2CA3(g)����Ӧ�ﵽƽ���������к���C2��0.5mol��A20.2mol��CA30.2mol�����ݻ�Ϊ1.0L��
2CA3(g)����Ӧ�ﵽƽ���������к���C2��0.5mol��A20.2mol��CA30.2mol�����ݻ�Ϊ1.0L��
�������ɴ�ƽ��ǰ��������ʼ���������¼��ֿ��ܣ����в���������________��
A��C2��0.6mol�� A2��0.5mol�� CA30mol
B��C2 0mol�� A2��0mol�� CA3��1.2mol
C��C2��0.6mol/L��A2��0.5mol/L�� CA3��0.1mol/L
�������ƽ����ϵ��ƽ�ⳣ��K��________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com