
某有机物分子的球棍模型如图所示,图中“棍”代表化学键,不同颜色的“球”代表不同元素的原子,下列说法错误的是
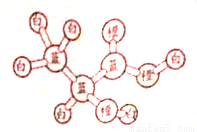
A. 1mol该有机物可与2molNa反应,生成1mol气体
B. 该有机物可以发生加聚反应
C. 该有机物可以发生取代反应,氧化反应、酯化反应
D. 该有机物可以生成分子式为C6H8O4的酯
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:2017届福建省厦门市高三下学期第一次质量检测理综化学试卷(解析版) 题型:选择题
设NA为阿伏加徳罗常数的值。下列有关叙述正确的是
A. .25℃时,1LpH =11的氨水中OH-为0.001 NA
B. 标准状况下,2.24 L SO3的氧原子数为0.3NA
C. 4.6 g乙醇中含有的共价键数为0. 7NA
D. 3.6gD2O所含质子数为2NA
查看答案和解析>>
科目:高中化学 来源:山东省2016-2017学年高一3月月考化学试卷 题型:选择题
下列说法正确的是 ( )
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
查看答案和解析>>
科目:高中化学 来源:2017届陕西省咸阳市高三二模理综化学试卷(解析版) 题型:选择题
下列实验能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 室温下,用pH试纸测得:0.1mol·L-1Na2SO3溶液的pH约为10;0.1mol·L-1NaHSO3溶液的pH约为5 | HSO3-结合H+的能力比SO32-强 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
C | 配置FeCl2溶液时,先将FeCl2固体溶于适量盐酸中,再用蒸馏水稀释到所需浓度,最后向试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
D | 向10mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,在滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届四川省南充市高三第二次高考适应性考试理综化学试卷(解析版) 题型:填空题
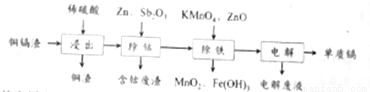
利用湿法炼锌产生的铜镉渣生产金属镉的流程如下:已知铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
(1)为了提高铜镉渣浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③______等。已知浸出的金属离子均为二价,写出浸出钴的化学方程式_________。
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3等形成微电池产生合金CoSb。该微电池的正极反应式为___________。
(3)除铁的过程分两步进行,①加入适量KMnO4,发生反应的离子方程式为___________,②加入ZnO控制反应液的pH范围为___________。
(4)除铁过程第①步,若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是______,若加入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证__________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是__________。
(6)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):
Ksp(CdCO3)=5.2×10-12 Ksp(CdS)=3.6×10-29 Ksp(Cd(OH)2)=2.0×10-16,根据上述信息:
沉淀Cd2+效果最佳的试剂是____________
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:实验题
环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯:
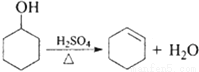
环己醇、环己烯的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
环己烯 | 83(70.8)* | 0.8085 | 不溶于水 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物中有机物的质量分数
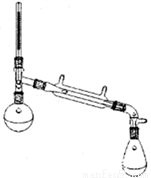
Ⅰ:制备环己烯粗品。实验中将环己醇与浓硫酸混合加入烧瓶中,按图所示装置,油浴加热,蒸馏约1h,收集馏分,得到主要含环己烯和水的混合物。
Ⅱ:环己烯的提纯。主要操作有;
a.向馏出液中加入精盐至饱和;
b.加入3~4mL5%Na2CO3溶液;
c.静置,分液;
d.加入无水CaCl2固体;
e.蒸馏
回答下列问题:
(1)油浴加热过程中,温度控制在90℃以下,蒸馏温度不宜过高的原因是________。
(2)蒸馏不能彻底分离环己烯和水的原因是_______________。
(3)加入精盐至饱和的目的是_____________________。
(4)加入3~4mL5%Na2CO3溶液的作用是__________。
(5)加入无水CaCl2固体的作用是______________。
(6)利用核磁共振氢谱可以鉴定制备的产物是否为环己烯,环己烯分子中有_______种不同环境的氢原子。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:选择题
—定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)  N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。

容器 | 温度/℃ | 起始物质的量浓度/mol·L-1 | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T1 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 乙容器中反应达到平衡时,N2的转化率大于40%
C. 达到平衡时,乙容器中的压强一定大于甲容器的2倍
D. 丙容器中反应达到平衡后,再充入0.10mol NO和0.10mol CO2,此时v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二3月月考化学试卷(解析版) 题型:填空题
有机物A是具有水果香味的液体,分子式是C4H8O2,在一定条件下有下列转化关系:
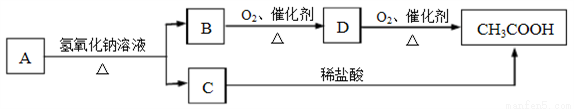
(1)写出A、B、C各物质的结构简式:
A__________、B__________、C__________。
(2)写出下列过程的反应方程式:
A→B和C______________________
B→D ____________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省西安市高二下学期第一次教学检测化学试卷(解析版) 题型:选择题
某烯烃与HCl加成后只能得到唯一产物2,3?二甲基?2?氯丁烷,则该烯烃的名称是( )
A. 3,3?二甲基?1?丁烯 B. 2,3?二甲基?2?丁烯
C. 2,3?二甲基?3?丁烯 D. 2,3?二甲基?1?丁烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com