
| A、硫酸铵溶液显酸性:NH4++H2O?NH3?H2O+H+ |
| B、向AgCl悬浊液中加Na2S溶液,白色沉淀变成黑色:2Ag++S2-=Ag2S↓ |
| C、将足量CO2通入Na2SiO3溶液中,出现白色沉淀:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
| D、向Na[Al(OH)4]溶液中加入NaHCO3溶液,出现白色沉淀:[Al(OH)4]++HCO3-═Al(OH)3↓+H2O+CO2 |


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| A、碳酸氢铵 | B、硝酸铵 |
| C、氯化铵 | D、磷酸氢二铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 高炉炼铁中发生的基本反应之一如下:FeO(固)+CO(气)?Fe(固)+CO2(气)(△H>0).
高炉炼铁中发生的基本反应之一如下:FeO(固)+CO(气)?Fe(固)+CO2(气)(△H>0).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤⑥ |
| B、①③④⑥⑧ |
| C、①②④⑥⑦ |
| D、③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 汽车尾气净化器中的主要反应为:2NO(g)+2CO(g)
汽车尾气净化器中的主要反应为:2NO(g)+2CO(g)| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
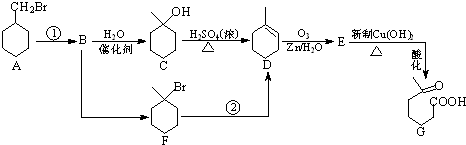
 、且属于酯类的同分异构体:
、且属于酯类的同分异构体:
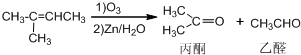
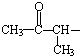
 )也可以发生“Diels-Alder反应”,该化学反应方程式为:
)也可以发生“Diels-Alder反应”,该化学反应方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com