
【题目】在工业上常用CO和H2合成甲醇,反应方程式为:
CO(g)+2H2(g)![]() CH3OH(g) △H = akJ/mol
CH3OH(g) △H = akJ/mol
已知:①CO(g)+![]() O2(g)== CO2(g) △H1=﹣283.0kJ/mol
O2(g)== CO2(g) △H1=﹣283.0kJ/mol
②H2(g)+![]() O2(g)== H2O(g)△H2=﹣241.8kJ/mol
O2(g)== H2O(g)△H2=﹣241.8kJ/mol
③CH3OH(g)+![]() O2(g)== CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
O2(g)== CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
回答下列问题:
(1)a = _______
(2)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是___(填字母)。
CH3OH(g)已达平衡状态的是___(填字母)。
A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与![]() 的关系如图1所示.
的关系如图1所示.
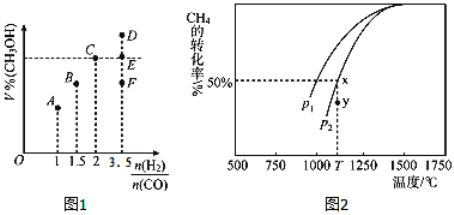
①当起始![]() =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
②当![]() = 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
= 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
(4)CO和H2来自于天然气。已知CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_______________p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______________v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_______________p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______________v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)含有甲醇的废水会造成环境污染,可通入ClO2气体将其氧化为CO2。写出相关反应的离子方程式_________________________________________。
【答案】 a =﹣574.4 C D 0.12mol/(L·min) 增大 F 小于 大于 4 6ClO2+5CH3OH=5CO2+6Cl﹣+7H2O+6H+
【解析】试题分析:本题考查盖斯定律的应用,化学平衡的标志,化学平衡图像的分析,平衡常数的计算,离子方程式的书写。
(1)应用盖斯定律,将①式+②式![]() 2-③式得,CO(g)+2H2(g)
2-③式得,CO(g)+2H2(g)![]() CH3OH(g) △H =ΔH1+2ΔH2-ΔH3=[(-283)+(-241.8)
CH3OH(g) △H =ΔH1+2ΔH2-ΔH3=[(-283)+(-241.8)![]() 2-(-192.2)]kJ/mol=-574.4kJ/mol,a=-574.4。
2-(-192.2)]kJ/mol=-574.4kJ/mol,a=-574.4。
(2)A项,单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g),只说明正反应,不能说明反应已达平衡状态;B项,在恒温恒容的容器中,根据质量守恒定律,混合气体的总质量始终不变,混合气体的密度始终不变,混合气体的密度保持不变不能说明反应已达平衡状态;C项,该反应为放热反应,在绝热恒容的容器中,随着平衡的建立温度升高平衡逆向移动,反应的平衡常数减小,反应的平衡常数不再变化说明反应已达平衡状态;D项,该反应的正反应为气体分子数减小的反应,建立平衡的过程中混合气体物质的量减小,混合气体的质量不变,混合气体的平均摩尔质量增大,气体的平均摩尔质量不再变化说明反应已达平衡状态;答案选CD。
(3)①当起始![]() =2时,起始CO、H2的物质的量依次为1mol、2mol。用三段式:
=2时,起始CO、H2的物质的量依次为1mol、2mol。用三段式:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
n(起始)(mol)1 2 0
n(转化)(mol)1![]() 0.6 1.2 0.6
0.6 1.2 0.6
n(平衡)(mol)0.4 0.8 0.6
0~5min内平均反应速率v(H2)=![]() =0.12mol/(L·min)。平衡时CO、H2、CH3OH的物质的量浓度依次为0.2mol/L、0.4mol/L、0.3mol/L,该温度下的化学平衡常数K=
=0.12mol/(L·min)。平衡时CO、H2、CH3OH的物质的量浓度依次为0.2mol/L、0.4mol/L、0.3mol/L,该温度下的化学平衡常数K=![]() =9.375;再向容器中加入CO(g)和CH3OH(g)各0.4mol,瞬时CO、H2、CH3OH的物质的量浓度依次为0.4mol/L、0.4mol/L、0.5mol/L,此时的浓度商为
=9.375;再向容器中加入CO(g)和CH3OH(g)各0.4mol,瞬时CO、H2、CH3OH的物质的量浓度依次为0.4mol/L、0.4mol/L、0.5mol/L,此时的浓度商为![]() =7.8125
=7.8125![]() 9.375,反应向正反应方向进行,H2的平衡转化率将增大。
9.375,反应向正反应方向进行,H2的平衡转化率将增大。
②当反应物按化学计量数之比投料,达到平衡时生成物的百分含量最大。当![]() = 3.5
= 3.5![]() 2,达到平衡状态后,CH3OH的体积分数应小于C点,可能是图象中的F点,答案选F。
2,达到平衡状态后,CH3OH的体积分数应小于C点,可能是图象中的F点,答案选F。
(4)该反应的正反应是气体分子数增大的反应,增大压强平衡逆向,反应物的转化率减小,由图像知温度相同时,p1时CH4的转化率大于p2时,则
CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
n(起始)(mol/L)0.1 0.1 0 0
n(转化)(mol/L)0.05 0.05 0.1 0.1
n(平衡)(mol/L)0.05 0.05 0.1 0.1
平衡时CO2、CH4、CO、H2物质的量分数依次为1/6、1/6、1/3、1/3,若p2=3MPa,则平衡时CO2、CH4、CO、H2的平衡分压依次为0.5MPa、0.5MPa、1MPa、1MPa,Kp=![]() =4MPa2。
=4MPa2。
(5)含有甲醇的废水会造成环境污染,可通入ClO2气体将其氧化为CO2,ClO2被还原成Cl-,写出反应CH3OH+ClO2→CO2+Cl-,C元素的化合价由-2价升至+4价,Cl元素的化合价由+4价降至-1价,根据元素化合价升降总数相等配平5CH3OH+6ClO2→5CO2+6Cl-,根据原子守恒和电荷守恒,写出反应的离子方程式为:5CH3OH+6ClO2=5CO2+6Cl-+6H++7H2O。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 氧化铝不能与水反应,它不是氢氧化铝对应的氧化物
B. 因为氧化铝是金属氧化物,所以它是碱性氧化物
C. 氧化铝能跟所有的酸碱溶液反应
D. 氧化铝能跟强的酸碱溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________________________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______。
(4)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K______1.0(填“大于”“小于”或“等于”)。
(5)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____移动(填“向正反应方向”“向逆反应方向”或“不”)。
(6)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为__________(填“正反应方向”“逆反应方向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )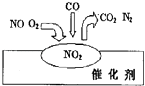
A.NO2是该过程的最终产物
B.NO和O2必须在催化剂表面才能反应
C.汽车尾气的主要污染成分是CO2和NO
D.该催化转化的总反应方程式为:2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学防护对预防病毒感染非常重要,下列说法错误的是
A.冠状病毒粒子直径约60-220 nm,介于溶液和胶体粒子之间
B.制作防护服和口罩的无纺布是有机高分子材料
C.免洗手消毒液的成分活性银离子、乙醇均能使蛋白质变性
D.二氧化氯泡腾片可用于水处理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com