
已知苯乙烯的结构为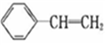 。有关该物质的下列说法正确的是
。有关该物质的下列说法正确的是
A. 该物质在一定条件下和氢气完全加成,加成产物的一溴取代物有6种
B. 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同
C. 苯乙烯分子的所有原子不可能在同一平面上
D. 除去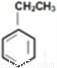 中的苯乙烯可以通入等量氢气反应
中的苯乙烯可以通入等量氢气反应
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列选项中,符合右图所示关系的是( )

A. 一定状况下,气体摩尔体积(Y)与该气体的物质的量(X)的关系
B. 在光照情况下,一定体积的饱和氯水的pH(Y)随时间(X)的关系
C. 100℃,1个大气压下,按体积比1∶1混合的CO2和H2O(g)混合气通过足量Na2O2粉末,固体增加的质量(Y)与混合气体积(X)的关系
D. 向AlCl3溶液中滴加NaOH溶液至过量,生成Al(OH)3 的物质的量(Y)与消耗NaOH的物质的量(X)的关系
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省盐城市高二学业水平模拟(一)化学试卷(解析版) 题型:选择题
下列有关二氧化硫的说法正确的是( )
A. 密度比空气小
B. 是无色无味的气体
C. SO2能使溴水褪色,说明SO2具有漂白性
D. 某生产硫酸厂区紫罗兰花变成白色,说明其周围空气中可能含较高浓度SO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省盐城市高二学业水平模拟(一)化学试卷(解析版) 题型:选择题
最近我国“人造太阳”研究获重大进展。核聚变中下列质子数小于中子数的原子是( )
A.  H B.
H B. 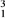 H C.
H C.  He D.
He D. 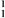 H
H
查看答案和解析>>
科目:高中化学 来源:2017届湖北省黄冈市高三第三次联考理综化学试卷(解析版) 题型:实验题
亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂。通常情况下,ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白。ClO2易发生爆炸,在生产、使用时可用其它气体进行稀释。ClO2易与碱反应生成亚氯酸盐和氯酸盐。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原氯酸钠,可较安全地生成ClO2,反应的离子方程式为___________。
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法作如下检测(已知ClO2存在于pH为4~6的溶液中,ClO2-存在于中性溶液中):
①取0.50L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式_____________。
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00ml,判断达到滴定终点的方法是_________。该水样中ClO2的浓度是___mg/L。
(3)某学习小组设计如下装置进行制取亚氯酸钠(NaClO2)。
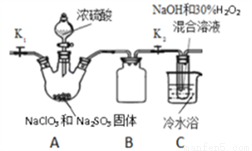
①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式为_______。将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。
②装置B的作用是____________。
③某同学认为上述装置并不完整,请画出需补充的装置图____________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省南阳、信阳等六市高三第一次联考理综化学试卷(解析版) 题型:简答题
连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,工业上可通过吸收大气污染物(含有SO2、NO等制取),同时还可得到NH4NO3产品,工艺流程图如下(Ce为铈元素):

请回答下列问题:
(1)装置I中可生成NaHSO3。常温下NaHSO3溶液呈酸性的原因是____________。
(2)装置II中酸性条件下,NO被Ce4+氧化为NO3- 时,氧化产物与还原产物的物质的量之比为______。
(3)装置III中阴极上的电极反应式为__________。若装置IV中NO2- 的浓度为11.5g·L-1要使1dm3该
溶液中的NO2- 完全转化为NH4NO3,至少向装置IV中通入标准状况下的O2__________L。
(4)Na2S2O4在空气中容易被氧化,其反应方程式可能为:
①2Na2S2O4+O2+2H2O=4NaHSO3;
②Na2S2O4+O2+H2O=NaHSO3+ NaHSO4。
请设计实验证明氧化时一定有反应②发生______________。
(5)SO2—空气质子交换膜燃料电池原理示意图如下图:

质子的流动方向为__________(“从A到B”或“从B到A”),负极的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省南阳、信阳等六市高三第一次联考理综化学试卷(解析版) 题型:选择题
下列有关性质的比较,不能用元素周期律解释的是
A. 碱性:KOH>NaOH B. 金属性:Na>Al
C. 稳定性:HF>CH4 D. 酸性:HClO<HClO4
查看答案和解析>>
科目:高中化学 来源:2017届江苏省常州市高三第一次模拟考试化学试卷(解析版) 题型:实验题
过硫酸钾( )具有强氧化性(常被还原为硫酸钾),80℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:

(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液。写出电解时发生反应的离子方程式___________________。
(2)已知相关物质的溶解度曲线如下图所示。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,___________,干燥。

(3)样品中过硫酸钾的含量可用碘量法进行测定。实验步骤如下:
步骤1:称取过硫酸钾样品0.3000g于碘量瓶中,加入30 mL水溶解。
步骤2:向溶液中加入4.000g KI固体(略过量),摇匀,在暗处放置30 min。
步骤3:在碘量瓶中加入适量醋酸溶液酸化,以淀粉溶液作指示剂,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液21.00mL。
(已知反应:I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将碘量瓶“在暗处放置30 min”,立即进行步骤3,则测定的结果可能__________(选填“偏大”、“偏小”、“无影响”);上述步骤3中滴定终点的现象是__________。
②根据上述步骤可计算出该样品中过硫酸钾的质量分数为__________。
③为确保实验结果的准确性,你认为还需要____________________。
(4)将0.40mol过硫酸钾与0.20mol硫酸配制成1 L溶液,在80℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如图所示(H+浓度未画出)。图中物质X的化学式为
__________。

查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济南市高一下学期开学考试化学试卷(解析版) 题型:选择题
下表是元素周期表的一部分,有关说法正确的是

A. e的氢化物比d的氢化物稳定
B. a、b、e三种元素的原子半径:e>b>a
C. 六种元素中,c元素单质的化学性质最活泼
D. c、e、f的最高价氧化物对应的水化物的酸性依次增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com