
【题目】下列关于铵盐的叙述中不正确的是
A. 常温下,都是易溶于水的晶体
B. 可用作氮肥
C. 热稳定性差,加热分解时一定产生NH3和酸
D. 跟强碱共热时,有氨气放出
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】综合处理“工业三废”,有利于保护环境,节约资源. 
(1)为处理某工厂的工业废气(主要含N2、SO2、NO、CO,不考虑其他成分),设计了如图1流程:
已知:NO+NO2+2NaOH=2NaNO2+H2O;
2NO2+2NaOH=NaNO3+NaNO2+H2O.
①废渣的成分为(填化学式).
②通入空气不能过量,原因是 .
③吸收剂所吸收的气体主要是
④处理含NH4+废水时,发生反应的离子方程式为
(2)某无色工业废水中可能含有NH4+、Na+、Al3+、Cu2+、Cl﹣、SO42﹣、CO32﹣等离子中的几种离子.为确定其成分,设计如下实验:
a.取10mL该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,充分反应后过滤得到0.04mol白色沉淀,向滤液中加入AgNO3溶液无沉淀产生.
b.另取10mL该废水于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后沉淀完全溶解.沉淀和气体的物质的量随加入NaOH溶液体积的变化关系如图2所示.(不考虑沉淀、气体的溶解和损失)
根据上述实验和图表数据:
①该废水中一定含有的离子有(填离子符号).
②实验室配制100mL所需浓度的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要(填仪器名称).
③图中a= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在国民经济中占有重要地位。
I.合成氨工业中,初始时氮气、氢气的体枳比为1:3时,每反应1mol N2,放出92.2kJ热量。如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数。
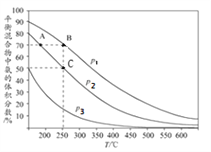
①由图可知:p1、p2、p3的大小关系为________,理由是_____________________________
②A、B点生成氨气的速率大小关系为_____________,C点,N2的转化率为_____。
③下列关于合成氨的说法正确是_________ (填序号)。
A.断开1个N≡N键的同时有6个N—H键形成,反应一定达到平衡状态
B.混合气体的平均相对分子质量不再改变状态,反应一定达到平衡状态
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
D.增大n(N2):n(H2)的比值,有利用提离H2的转化率
II.最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其电池反应为4NH3+3O2==2N2+6H2O,写出负极的电极反应式:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:下列说法不正确的是
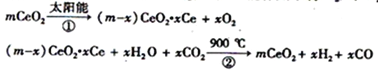
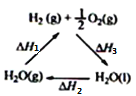
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 右图中△H1=△H2+△H3
D. 以CO和O2构成的碱性燃料电池的负极反应式为:CO+4OH—- 2e—=CO32—+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适当的数据填写在空格中:
(1)0.5molNaOH的质量是g,10gNaOH的物质的量是mol.
(2)在标准状况下0.5molH2的体积为L,在标况下5.6LH2的物质的量为mol.
(3)将58.5gNaCl溶于水配制成500mL溶液,此溶液中溶质的物质的量浓度为;取此溶液100mL,其中Na+的物质的量浓度为 , Na+的物质的量是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)写出下列物质的电离方程式:
Ba(OH)2;
Fe2(SO4)3;
H2SO4 .
(2)如果NaHSO4的电离方程式可以写成:NaHSO4=Na++H++SO42﹣ . 那么,将NaHSO4溶液与氢氧化钠溶液完全反应的离子方程式是: .
(3)用“双线桥”法,对反应MnO2+4HCl=MnCl2+Cl2+2H2O进行化合价变化、电子转移以及氧化、还原分析. , 其中氧化剂是 , 还原剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)现有如下两个反应:(A)NaOH+HCl=NaCl+H2O(B)2FeCl3+Cu=2FeCl2+CuCl2
①根据两反应本质判断,能设计成原电池(填“A”或“B”).
②如果(A或B)不能,说明其原因 .
(2)如图所示装置,烧杯中盛有滴有酚酞的NaCl饱和溶液,C(1)、C(2)为多孔石墨电极.
①接通S1后,两极均有气体生成,C(1)附近溶液显色.装置内发生的总反应化学方程式为 .
②若有11.7g NaCl发生反应,理论上生成Cl2的体积(标准状况)为 .
③反应一段时间后(电极未脱离液面),断开S1 , 接通S2 , 观察到二极管发光.此时:C(2)的电极反应式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com