
【题目】在建国70周年阅兵仪式上,“歼20”“东风-41 核导弹”等国之重器亮相,它们采用了大量合金材料。回答下列问题:
(1)查阅资料显示第二电离能 Cu 大于 Zn,理由是 _____________。
(2)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中阴离子的立体构型为______,S的_____杂化轨道与O的2p轨道形成______键(填“π”或“σ”)。
(3)铁元素能与 CO 形成 Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含___molσ键,与CO互为等电子体的一种离子的化学式为____。
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为__(填字母序号)。
A.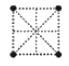 B.
B.  C.
C.  D .
D .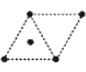
a. 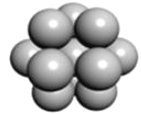 b.
b. 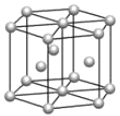 c.
c. 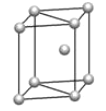
(5) 镁单质晶体中原子的堆积模型如图,它的堆积模型名称为__;晶胞是图中的_(填 a、b 或 c);配位数是___;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ gcm-3,已知阿伏德罗常数为NA,则镁的摩尔质量的计算式是_______。
【答案】锌失去 4s1电子,而铜失去 3d10 电子,后者全充满较稳定,更难失去 正四面体 sp3 σ 10 CN- D 六方最密堆积 c 12 12NAaρ
【解析】
(1)第二电离能 Cu 大于 Zn,理由是锌失去 4s1电子,而铜失去 3d10 电子,后者全充满较稳定,更难失去。故答案为:锌失去 4s1电子,而铜失去 3d10 电子,后者全充满较稳定,更难失去;
(2)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中硫酸根离子中心原子价层电子对为:4+![]() =4,S采用sp3,没有孤电子对,立体构型为正四面体,S的sp3杂化轨道与O的2p轨道形成σ键。故答案为:正四面体;sp3;σ;
=4,S采用sp3,没有孤电子对,立体构型为正四面体,S的sp3杂化轨道与O的2p轨道形成σ键。故答案为:正四面体;sp3;σ;
(3)1molFe(CO)5分子中含C-O键和铁碳配位键各5mol,共10molσ键,将CO中O换成N得与CO互为等电子体的一种离子的化学式为CN-。故答案为:10;CN-;
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为![]() 。故答案为:D;
。故答案为:D;
(5)镁单质晶体中原子的堆积方式是按ABABABAB…的方式堆积,镁单质晶体中原子的堆积模型名称为六方最密堆积;晶胞是图中的 c;配位数是12;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ gcm-3,已知阿伏德罗常数为NA,由于紧邻的四个镁原子的中心连线构成的几何体为正四面体,正四面体的该高为晶胞的![]() ,可推知四面体的体积为整个晶胞的
,可推知四面体的体积为整个晶胞的![]() ,而晶胞中含有的镁原子数为1+8×
,而晶胞中含有的镁原子数为1+8×![]() =2,则晶胞质量=
=2,则晶胞质量=![]() g,则ρg·cm-3=
g,则ρg·cm-3=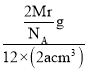 ,则有Mr=12NA·a·ρ,则镁的摩尔质量的计算式是12NAaρ。故答案为:六方最密堆积;c;12;12NAaρ。
,则有Mr=12NA·a·ρ,则镁的摩尔质量的计算式是12NAaρ。故答案为:六方最密堆积;c;12;12NAaρ。


科目:高中化学 来源: 题型:
【题目】铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生如下反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
容器 | 容器类型 | 初始体积 | 初始压强/Pa | 反应物投入量/mol | 平衡时Cl2的物质的量/mol | |||
HCl | O2 | Cl2 | H2O | |||||
I | 恒温恒容 | 1L |
| 4 | 1 | 0 | 0 | 1 |
II | 绝热恒容 | 1L | p2 | 0 | 0 | 2 | 2 | a |
III | 恒温恒压 | 2L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
A.反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
B.a>1, b>2
C.p2=1.6×105Pa,p3=4×105Pa
D.若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.FeSO4溶液与氨水反应的离子方程式:Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+
C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入1L1mol/L食盐水中。下列说法正确的是( )
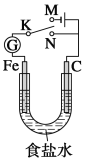
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH--4e-=2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生28L(标准状况)气体时,生成了1.25molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯与甲苯都是重要的有机化工原料.
(1)乙烯通入到Br2水中,现象是_____________.
(2)由甲苯获取食品香料添加剂苯甲酸苯甲酯,存在下列转化:
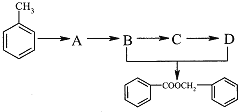
回答下列问题:
①C中的官能团名称____________,C→D的反应类型________________.
②B→C的化学方程式为________________.
③B+D→ ![]() 的化学方程式为_____________________.
的化学方程式为_____________________.
④A的化学式为C7H7Cl,则含有苯环的A的同分异构体还有______________种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y,Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述正确的是
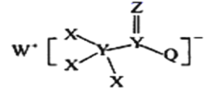
A.WX是共价化合物
B.最高价氧化物对应的水化物的酸性:Q<Y
C.原子半径:W>Z>Y
D.Z和X、Y、W、Q均形成至少两种二元化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.MnO2与浓盐酸混合加热:MnO2+4H++4Cl-![]() MnCl2+ Cl2↑+2H2O
MnCl2+ Cl2↑+2H2O
B.氢氧化钡溶液中加入硫酸铵:Ba2++OH-+![]() +
+![]() ===BaSO4↓+NH3·H2O
===BaSO4↓+NH3·H2O
C.FeSO4溶液中加入盐酸酸化的H2O2:Fe2++H2O2+2H+===Fe3++2H2O
D.0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合:![]() +Al3++2
+Al3++2![]() +2Ba2++4OH-===2BaSO4↓+Al(OH)3↓+NH3·H2O
+2Ba2++4OH-===2BaSO4↓+Al(OH)3↓+NH3·H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com