
【题目】已知100 kPa、298.15 K时氢氟酸的电离过程HF(aq)H+(aq)+F-(aq) ΔH=-12.5kJ·mol-1,ΔS=-102.5 J·mol-1·K-1,试判断该过程的自发性( )
A. 可自发进行 B. 不能自发进行 C. 达到平衡 D. 不能判定
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】室温下,某碳酸溶液中的H2CO3、HCO3-、CO23-的物质的量分数δ随pH的变化如下图所示。下列叙述错误的是( )

A. 当溶液中δ(HCO3-)达到最大时:c(H2CO3)>c(CO32-)
B. Ka2(H2CO3)的数量级为10-11
C. 调节溶液的pH由8~10的过程中![]() 减小
减小
D. 加入NaOH使溶液pH=9时,主要反应为HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有11.2 g KOH的稀溶液与1 L 0.1 mol/L的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应中和热的化学方程式为( )
A.KOH(aq)+H2SO4(aq)===K2SO4(aq)+H2O(l) Δ H=-11.46 kJ/mol
B.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-11.46 kJ/mol
C.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol
D.KOH(aq)+![]() H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时,生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是
A. 溶液A和B均可以是盐酸或氢氧化钠溶液
B. 溶液A和B均可以选用稀硝酸
C. 若溶液B选用氯化铁溶液,则实验难以实现
D. 实验方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为由石油制取汽油的装置示意图,根据图示回答下列问题。
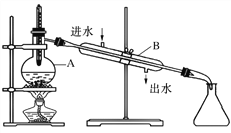
(1)图中的两处明显的错误是________________、__________________
(2)A仪器的名称是________,B仪器的名称是________。
(3)实验时 A 中除加入石油外,还需加入少量__________,其作用是__________________。
(4)收集完汽油后,是先撤酒精灯还是先停冷凝水?
______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:
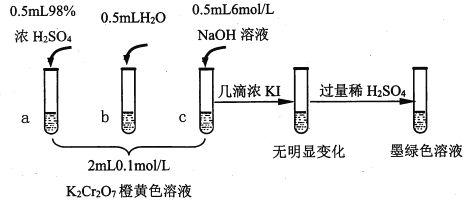
已知:Cr2O72- (橙色)+H2O![]() 2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是________。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?____(“是”或“否”),理由是_________________________________。
(3)对比试管a、b、c的实验现象,得到的结论是________________。
(4)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是_______;写出此过程中氧化还原反应的离子方程式________________。
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如下表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
实验 | ⅰ | ⅱ | ⅲ | ⅳ |
是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
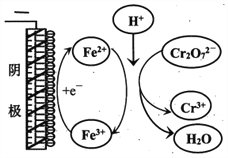
①实验ⅱ中Cr2O72-放电的电极反应式是________________。
②实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时H2A的pKa1=1.85;pKa2=7.19。常温下,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如右图所示(曲线上的数字为pH)。下列说法正确的是
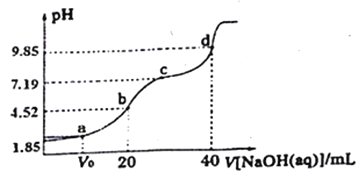
A. a点所得溶液中c(HA)+c(A2-)+c(HA-)=0.1mol/L
B. b点所得溶液中:c(H2A)+2c(H+)=c(A2-)+2c(OH-)
C. 对应溶液水的电离程度:a>b>c>d
D. C点所得溶液中:c(Na+)>3c(HA-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com