

25℃时, 已知反应:CO2(g) + H2(g) CO (g) + H2O (g) △H = + 41 kJ/mol。回答下列问题:
(1)该反应属于 反应(“放热”或“吸热”), 判断依据是
(2)能判断该反应是否已达平衡状态的依据是 (填序号)。
a.混合气体中n(CO)不变 b. v消耗(CO2) = v生成(CO)
c.混合气的总物质的量不变 d. 容器中压强不变 e. c(CO)= c(H2O)
(3)一定条件下的密闭容器中,反应达到平衡,要提高CO2的转化率,可以采取的措施是________(填序号)。
a.向体系中通入CO2 b.降低温度
c.向体系中通入惰性气体 d.向体系中通入H2 e.加入催化剂
(4)25℃时,已知: 2C(石墨) + O2 (g) = 2CO(g) △H1 = -222 kJ/mol
H2(g) + 1/2O2(g) = H2 O (g) △H2 = -242 kJ/mol
结合题中信息,写出石墨与氧气反应生成1mol CO2的热化学方程式
。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:022
丙酮和碘在酸性溶液中发生以下反应:
![]() +HI-,25℃时,该反应速率由下列经验公式决定:
+HI-,25℃时,该反应速率由下列经验公式决定:![]() ,式中k的值为2.73×10-3 L·mol-1·s-1。25℃时,已知反应开始时c(I2)=0.01mol·L-1,
,式中k的值为2.73×10-3 L·mol-1·s-1。25℃时,已知反应开始时c(I2)=0.01mol·L-1,![]() , c(H+)=0.01mol·L-1。
, c(H+)=0.01mol·L-1。
则:(1)反应开始时的速率是多少?
(2)当溶液中c(I2)剩下0.005mol·L-1时,反应速率比开始时慢还是快?为什么?
查看答案和解析>>
科目:高中化学 来源: 题型:
 +H++I-,25 ℃时,该反应速率由下列经验公式决定:v=k·c(
+H++I-,25 ℃时,该反应速率由下列经验公式决定:v=k·c(![]() )·c(H+),式中k的值为2.73×10-3 L·mol-1·s-1。25 ℃时,已知反应开始时c(I2)=0.01 mol·L-1,c(
)·c(H+),式中k的值为2.73×10-3 L·mol-1·s-1。25 ℃时,已知反应开始时c(I2)=0.01 mol·L-1,c(![]() )
)
=0.1 mol·L-1,c(H+)=0.01 mol·L-1。
求:(1)反应开始时的速率是多少?
(2)当溶液中c(I2)剩下0.005 mol·L-1时,反应速率比开始时慢还是快?为什么?
查看答案和解析>>
科目:高中化学 来源: 题型:
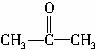 25 ℃时,该反应速率由下列经验公式决定:v=k·c(
25 ℃时,该反应速率由下列经验公式决定:v=k·c(![]() )·c(H+),式中k的值为2.73×10-3L·mol-1·s-1。25
)·c(H+),式中k的值为2.73×10-3L·mol-1·s-1。25![]() )=0.1mol·L-1,c(H+)=0.01mol·L-1。?
)=0.1mol·L-1,c(H+)=0.01mol·L-1。?
则:(1)反应开始时的速率是多少??
(2)当溶液中c(I2)剩下0.005mol·L-1时,反应速率比开始时慢还是快?为什么?????
查看答案和解析>>
科目:高中化学 来源: 题型:
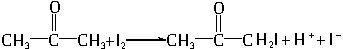
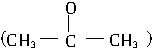 ?c(H+),式中k的值为2.73×10-3L?mol-1?s-1。25℃时,已知反应开始时c(I2)=0.01mol?L-1,c
?c(H+),式中k的值为2.73×10-3L?mol-1?s-1。25℃时,已知反应开始时c(I2)=0.01mol?L-1,c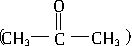 =0.1mol?L-1,c(H+)=0.01mol?L-1。
=0.1mol?L-1,c(H+)=0.01mol?L-1。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com