
下列实验操作中,正确的是
A、配制5%NaCl溶液时,将称量的NaCl放入烧杯中加计量的水搅拌溶解
B、配制1mol·L-1NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶
C、配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
D、取用一小块钠时,将剩余的钠丢进废液缸
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
根据元素周期表和元素周期律分析下面的判断,其中错误的是 ( )
A、铍(Be)的原子失电子能力比镁弱 B、砹(At)的氢化物不稳定
C、硒(Se)化氢比硫化氢稳定 D、氢氧化锶[Sr(OH)2]比氢氧化钙碱性强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中的氨与反应4NH3 + 5O2 → 4NO + 6H2O中的氨作用相同的是 ( )
A.2Na + 2NH3 → 2NaNH2 + H2↑ B.NH3 + HNO3→ NH4NO3
C.4NH3 + 6NO → 5N2 + 6H2O D.3SiH4 + 4NH3 → Si3N4 + 12H2
查看答案和解析>>
科目:高中化学 来源: 题型:
单质Z是一种带有金属光泽的灰黑色固体,可由X通过如下图所示的路线制备,其中X为Z的氧化物,Y为氢化物,分子结构与甲烷相似,回答下列问题:

(1)写出单质Z的一种工业用途 _____________________________________;
由X制备Mg2Z的化学方程式为____________________________________。
(2)由Mg2Z生成Y的化学反应方程式为__________________________________,
Y分子的电子式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.32g O2中含有32NA个电子
B.22.4L N2含有阿伏加德罗常数个氮分子
C.在标准状况下,22.4L水的质量约为18g
D.常温常压下22g的CO2与标准状况下11.2L HCl含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏德罗常数,下列叙述正确的是 ( )
A.标准状况下,22.4LH2O含有的分子数为 NA
B.通常状况下,NA 个CO2分子占有的体积为22.4L
C.物质的量浓度为1mol/L的MgCl2溶液中,含有Cl—个数为2NA
D.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
⑴写出滴定过程中发生反应的离子方程式为 。
⑵滴定过程中操作滴定管的图示正确的是 。
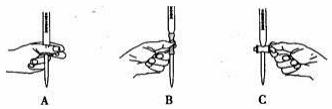
⑶若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度 (填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
| 实验编号 | 温 度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究
b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影响。 |
| 体积(mL) | 浓度 (mol•L-1) | |||
| 1 | 25 | 0.5 | 4 | 0.1000 |
| 2 | 50 | 0.5 | 4 | 0.1000 |
| 3 | 25 | 0.5 | 4 | 0.0100 |
| 4 | 25 | 0 | 4 | 0.1000 |
⑷写出表中a 对应的实验目的 ;
⑸该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1 次 | 第2 次 | 第3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案_________。
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示)
为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com