
����Ŀ��ij����ֻ��C��H��O����Ԫ�أ�����ӵ����ģ����ͼ��ʾ�������й���12��ԭ��(ͼ��������֮������ߴ���������˫���Ȼ�ѧ��)��

(1)�������к��������ŵĽṹ��ʽΪ________��
(2)���������У�������ʻ�Ϊͬ���칹�����________(�����)��
A��CH3CH2CH2COOH
B��OHCCH(CH3)CHO
C��CH3CH2CH===CHCOOH
D��CH2===CHCOOCH3
(3)�÷����й�ƽ���ԭ�������Ϊ________(��֪�Ȼ����ĸ�ԭ�ӿ��Թ�ƽ��)��
���𰸡���COOH BD 10
��������
�������ʳɼ��ص��֪������4����������C����һ���жϳ�С����ΪH����һ��ΪO��
(1)���ݷ���ģ�Ϳ�֪�������ʵĽṹ��ʽΪCH2===C(CH3)COOH������������Ϊ-COOH����Ϊ��-COOH��
(2) A. CH3CH2CH2COOH��CH2===C(CH3)COOH����ʽ��ͬ��A����
B. OHCCH(CH3)CHO��CH2===C(CH3)COOH����ʽ��ͬ���ṹ��ͬ����Ϊͬ���칹�壬B��ȷ��
C. CH3CH2CH===CHCOOH��CH2===C(CH3)COOH����ʽ��ͬ��C����
D. CH2===CHCOOCH3��CH2===C(CH3)COOH����ʽ��ͬ���ṹ��ͬ����Ϊͬ���칹�壬D��ȷ����Ϊ��BD��
(3)̼̼˫����ƽ��ṹ���Ȼ����ĸ�ԭ�ӿ��Թ�ƽ�棬��ͼ��ʾ���÷����й�ƽ���ԭ�������Ϊ10��(���С�����)��

����10��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���Ը���Ϊԭ�����ǣ��Բ����Ĵ�������������ͼ��ʾת�������ۺ����ã����ַ�Ӧ����������û���г�����
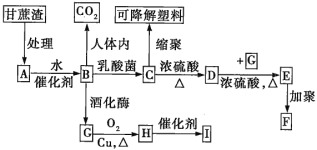
����B��Aˮ������ղ��C�ķ���ʽΪC3H6O3��һ��������2��C���ӷ��Ӽ���ȥ2����ˮ������һ����Ԫ��״�����D��ʹ��ˮ��ɫ��H��������IҲ��һ����Ԫ��״�����
��ʾ����������������������������ᣨ![]() ����
����
��1��C��D�ķ�Ӧ����Ϊ__��D��E�ķ�Ӧ����Ϊ__��
��2��д��A��B��Ӧ�Ļ�ѧ����ʽ��_��
��3��H���������������ŵ�������__��ʵ�����г����ڼ���ù����ŵ��Լ���������_��ֻдһ�֣���
��4��д���������ʵĽṹ��ʽ���߷��ӻ�����F__����Ԫ��״������I_��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�����ʵ�Ļ�ѧ��������ȷ����
A. ��п��(ZnS)��CuSO4��Һ���ú�ת��Ϊͭ��(CuS)��ZnS + Cu2+ === CuS + Zn2+
B. 0.1 mol/L �Ĵ�����ҺpHԼΪ3��CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C. ���NaCl��Һ����������ҺpH����2H2O + 2e- === H2��+ 2OH-
D. ��������������ʴ��������ӦΪ��Fe��3e- === Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�ش��������⣺
��1��������ʵ���ã�5g�״��������г��ȼ�����ɶ�����̼�����Һ̬ˮʱ�ͷų�113.5kJ����������д���״�ȼ�յ��Ȼ�ѧ����ʽ��___��
��2���������������ȼ�յ��Ȼ�ѧ����ʽΪSi(s)+O2(g)=SiO2(s) ��H=-989.2kJ��mol-1���йؼ����������±���
��ѧ�� | Si��O | O=O | Si��Si |
����/kJ��mol-1 | x | 498.8 | 176 |
��֪1molSi�к�2molSi��Si����1molSiO2�к�4molSi��O������x��ֵΪ__��
��3��AgNO3��ˮ��Һ��___�����������������������������ԣ�ʵ����������AgNO3����Һʱ������AgNO3���������ڽ�Ũ�������У�Ȼ����������ˮϡ�͵������Ũ�ȣ�Ŀ����___��
��4����ϡ�ʹ���Ĺ����У�����ʼ�ձ����������Ƶ�������______��
A.c(H+) B.H+���� C.CH3COOH������ D.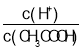
��5��ij�¶�(t��)ʱ��ˮ�����ӻ�ΪKw=1��10-13���������¶���pH=11�Ŀ�������ҺaL��pH=1��ϡ����bL���(���Ϻ���Һ�����С�仯���Բ���)�������û����Һ��pH=2����a��b=__��
��6����֪Cr(OH)3����Һ�д������³����ܽ�ƽ�⣺Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)�������£�Cr(OH)3���ܶȻ�Ksp=10-32��Ҫʹc(Cr3+)����10-5mol��L-1����Һ��pHӦ���ٵ���__��
Cr3+(aq)+3OH-(aq)�������£�Cr(OH)3���ܶȻ�Ksp=10-32��Ҫʹc(Cr3+)����10-5mol��L-1����Һ��pHӦ���ٵ���__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�� X��Y��Z��W ԭ��������������Y �� W ͬ�塣X��Y��Z ����ԭ�������������Ĺ�ϵ Ϊ X+Z=Y����� Z �� W �γɵĻ������ˮ��Һ������ W Ԫ�ص����嵥�ʣ�������ͬ���ռ���Һ�� �ã��ɵõ������� ZWX ����Һ������˵����ȷ����
A.W ���⻯���ȶ���ǿ�� Y ���⻯��
B.Z����������Ԫ�طֱ��γɵĻ�������ֻ�������Ӽ�
C.Z �� Y �γɵĻ������ˮ��Һ�ʼ���
D.��Ӧ�ļ����Ӱ뾶��СΪ W >Z > X>Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ����������������ԭ�����͵���
A.��ˮ��������ƽ��Cl2+H2 OHCl + HClO��������AgNO3��Һ����Һ��ɫ��dz
B.��2HI(g)H2(g)+I2 (g)��ƽ����ϵ����ѹǿ��ʹ��ɫ����
C.��ӦCO+NO2CO2+NO ��H <0�������¶ȿ�ʹƽ�����淴Ӧ�����ƶ�
D.�ϳ�NH3��Ӧ��Ϊ���NH3�IJ��ʣ�������Ӧ��ȡ�����¶ȵĴ�ʩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʾ���ʱ仯�Ļ�ѧ�����У���ȷ����
A.���������绯ѧ��ʴ��������Ӧʽ��Fe-2e-=Fe2+
B.����ȼ�ϵ�صĸ�����Ӧʽ��O2+2H2O+4e-=4OH-
C.��ͭ����ʱ�����Դ�����������Ǵ�ͭ���缫��ӦʽΪ��Cu-2e-=Cu2+
D.��ⱥ��ʳ��ˮʱ�������ĵ缫��ӦʽΪ��2Cl--2e-=Cl2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʮ�Ŵ����Ҫ�Ի����������ȫ�桢ϵͳ�Ŀɳ�����������ɫ��Դ��ʵʩ�ɳ�����չ����Ҫ;�������������Ҵ�����ȡ��ɫ��Դ�����IJ��ַ�Ӧ��������ͼ��ʾ��

��1����֪��CO(g)+H2O(g) ![]() CO2(g)+H2(g) ��H1= - 41 kJ/mol
CO2(g)+H2(g) ��H1= - 41 kJ/mol
CH3CH2OH(g)+3H2O(g) ![]() 2CO2(g)+6H2(g) ��H2=+174.1 kJ/mol
2CO2(g)+6H2(g) ��H2=+174.1 kJ/mol
��д����ӦI���Ȼ�ѧ����ʽ__________________________________________________________��
��2����ӦII���ڽ�����[n(CO) : n(H2O)]��ͬʱ�������Ӧ��COƽ��ת���ʼ���ͼ�������Ӧ�ķ�Ӧ�¶ȿ�����ͬ��Ҳ���ܲ�ͬ�������Ӧ��������Ӧ��������ͬ����
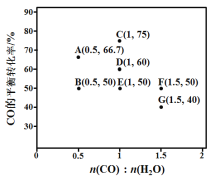
�پ�������A��E��G�����Ӧ�ķ�Ӧ�¶���ͬ����ԭ����KA=KE=KG=__________������ֵ�����ڸ��¶��£�Ҫ���COƽ��ת���ʣ����˸ı������֮�⣬���ɲ�ȡ�Ĵ�ʩ��_____
�ڶԱȷ���B��E��F���㣬�ɵó���Ӧ�Ľ����Ⱥͷ�Ӧ�¶ȵı仯����֮��Ĺ�ϵ��________
�۱Ƚ�A��B�����Ӧ�ķ�Ӧ���ʴ�С��VA________VB������<�� ��=������>��������Ӧ����v=v��v��= K��X(CO)![]() X(H2O) �CK��X( CO2)
X(H2O) �CK��X( CO2)![]() X(H2)��K����K���ֱ�Ϊ��Ӧ���ʳ�����XΪ���ʵ��������������ڴﵽƽ��״̬ΪD��ķ�Ӧ�����У���COת���ʸպôﵽ20%ʱ
X(H2)��K����K���ֱ�Ϊ��Ӧ���ʳ�����XΪ���ʵ��������������ڴﵽƽ��״̬ΪD��ķ�Ӧ�����У���COת���ʸպôﵽ20%ʱ
![]() =__________ ������������1λС������
=__________ ������������1λС������
��3����ӦIII������̼�����Һ����CO2�õ����͵�KHCO3���Һ�������CO2���Ʊ��Ҵ���
����֪̼��ĵ��볣��Ka1=10-a��Ka2=10-b����������CO2���ñ���KHCO3��Һ��pH=c�������Һ��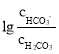 =________���г�����ʽ����
=________���г�����ʽ����
���ڱ���KHCO3���Һ�е��CO2���Ʊ��Ҵ���ԭ����ͼ��ʾ���������ĵ缫��Ӧʽ��________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ���ı�����RCOOH��Һ��pH����Һ��RCOOH���ӵ����ʵ���������(RCOOH)��֮�ı䣬0.1mol/L����(HCOOH)�����(CH3CH2COOH)��Һ����(RCOOH)��pH�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
��֪����(RCOOH)=![]()
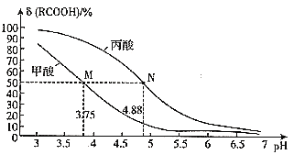
A.��Ũ�ȵ�HCOONa��CH3CH2COONa������Һ��ˮ�ĵ���̶ȱȽϣ�ǰ��>����
B.����Ũ�ȵ�HCOOH��Һ��HCOONa��Һ�������ϣ�������Һ�У�c(HCOOH)+2c(H+)>c(OH-)+c(HCOO-)
C.ͼ��M��N�����Ӧ��Һ�е�Kw�Ƚϣ�ǰ��>����
D.1mol/L����ĵ��볣��K��10-4.88
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com