
下列关于证明醋酸是弱电解质的实验方法不正确的是
A.常温下,测定0.1mol·L-1CH3COOH的pH值,若pH大于1,即可证明为弱电解质
B.等体积的0.1mol·L-1HCl和 0.1mol·L-1醋酸溶液,分别与等量的相同颗粒度的Zn反应,观察产生气泡的速率,即可证明
0.1mol·L-1醋酸溶液,分别与等量的相同颗粒度的Zn反应,观察产生气泡的速率,即可证明
C.等体积的0.1mol·L-1HCl和 0.1mol·L-1醋酸溶液,比较中和这两种酸所需相同物质的量浓度的NaOH溶液的体积,即可证明
D.常温下,测一定浓度的CH3COONa溶液的pH值,若pH大于7,即可证明
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年吉林长春十一高中等两校高二上期末化学卷(解析版) 题型:选择题
下列说法不正确的是
A.可以利用铝热反应冶炼高熔点的金属
B.现代石油化工,采作银作催化剂可以实现一步完成乙烯转化为环氧乙烷的过程,该反应的原子利用率为100%
C.工业上制溴是向酸化的浓缩海水中直接通入氯气置换出溴即可
D.煤直接液化可得液体燃料
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高一上期末化学试卷(解析版) 题型:选择题
根据:2Fe3++2I-=2Fe2++I2;Br2+2Fe2+=2Fe3++2Br-两个反应,判断Fe3+、I2、Br2的氧化性顺序为
A.I2>Fe3+>Br2 B.Br2>I2>Fe3+ C.Br2>Fe3+>I2 D.Fe3+>Br2>I2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:填空题
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已 知:2SO2(g)+O2(g)
知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6kJ·mol-1
2SO3(g) ΔH=-196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0kJ·mol-1
2NO2(g) ΔH=-113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=____________ kJ·mol-1。
SO3(g)+NO(g)的ΔH=____________ kJ·mol-1。
(2)一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____________。
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1molSO3的同时生成1mol NO
若测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K= 。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g
CH3OH(g )。CO在不同温度下的平衡转化率与压强的关系如图甲所示。该反应ΔH________0(填“>”或“<”)。
)。CO在不同温度下的平衡转化率与压强的关系如图甲所示。该反应ΔH________0(填“>”或“<”)。
图甲: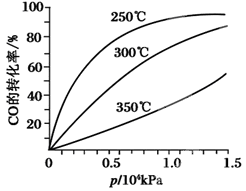 图乙:
图乙:
(4)依据燃烧的反应原理,合成的甲醇可以设计如图乙所示的原电池装置。
①该电池工作时,OH-向_______极移动(填“正”或“负”)。
②该电池正极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:选择题
如图所示,a和b是盐酸和氢氧化钠溶液相互反应的pH值变化曲线,下列说法不正确的是
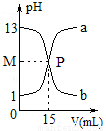
A.NaOH的物质的量浓度:c(NaOH)=0.1mol·L-1
B.a和b曲线上的任何一点都有:c(Na+)+c(H+)=c(Cl-)+c(OH-)
C.P点溶液中:c(Na+)=c(Cl-)> c(H+)=c(OH-)
D.曲线b是氢氧化钠溶液中逐滴加入盐酸的pH值变化曲线
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是
A.电解饱和食盐水:2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.硫酸铵稀溶液和稀氢氧化钡溶液反应:NH4++SO42-+Ba2+ +OH-=BaSO4↓+NH3·H2O
C.把氯气通入NaOH 溶液中:Cl2+2OH-=Cl-+ClO- +2H2O
D.碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO3-+OH-=H2O+CaCO3↓
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.由于铜盐能杀死某些细菌,并能抑制藻类生长,因此游泳场馆常用硫酸铜作池水消毒剂
B.高炉炼铁得到纯度高的铁,加入其他金属炼制得到钢
C.焙制糕点的发酵粉主要成分之一是碳酸氢钠,它也是治疗胃酸过多的一种药剂
D.分子筛常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上期末化学卷(解析版) 题型:选择题
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装了盛有Na2O2(或 K2O2)颗粒的装置,它的用途是产生氧气。下列有关 Na2O2的叙述正确的是
A.Na2O2中阴、阳离子的个数比是 1∶1
B.Na2O2分别与水及CO2反应产生相同量氧气时,需水和 CO2的质量相等
C.Na2O2的漂白原理与 SO2的漂白原理相同
D.与 CO2、H2O反应产生等量氧气,转移电子数相同,耗Na2O2的质量相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期期末化学试卷(解析版) 题型:填空题
(1)请将下列变化过程中破坏的微粒间作用力名称的编号填在横线上:
A共价键 B离子键 C金属键 D分子间作用力
氢氧化钠熔化 ;②干冰升华 ;
③二氧化硅熔化 ;④钠熔化 。
(2)单质硼有无定形和晶体两种,参考下表数据。

①根据表中数据判断晶体硼的晶体类型属于 晶体;
②请解释金刚石的熔沸点高于晶体硅的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com