
| A. | 人工牛胰岛素的合成,标志着人类在化学合成技术上迈出了重要的一步 | |
| B. | 牛胰岛素的水溶液可产生丁达尔效应 | |
| C. | 结晶牛胰岛素合成之前,应先确定每条链上氨基酸的排列顺序 | |
| D. | 结晶牛胰岛素双链之间通过肽键联接 |
分析 A.1965年9月17日,中国首次合成了具有生物活性的蛋白质---结晶牛胰岛素;
B.结晶牛胰岛素是蛋白质;
C.结晶牛胰岛素的多条肽链在氨基酸的排列顺序上互不相同;
D.蛋白质的空间结构与二硫键有关.
解答 解:A.中国首次合成了具有生物活性的蛋白质---结晶牛胰岛素,标志着人类在化学合成技术上迈出了重要的一步,故A正确;
B.结晶牛胰岛素是蛋白质,水溶液为胶体,可产生丁达尔效应,故B正确;
C.结晶牛胰岛素的多条肽链在氨基酸的排列顺序上互不相同,合成之前,应先确定每条链上氨基酸的排列顺序,故C正确;
D.胰岛素分子的两条肽链之间通过二硫键连接,故D错误.
故选D.
点评 本题考查蛋白质的结构与性质,难度不大,注意掌握蛋白质的二级结构和肽链之间的作用力.


科目:高中化学 来源: 题型:解答题
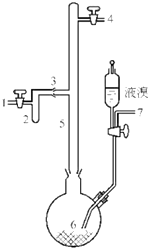 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加成反应 | B. | 水解反应 | C. | 氧化反应 | D. | 消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热煮沸 | B. | 向水中投入一小块金属钠 | ||
| C. | 向水中通入二氧化硫气体 | D. | 向水中加食盐晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | Y | ||
| Z | W | M |
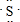 ;它的气态氢化物的结构式为H-S-H.
;它的气态氢化物的结构式为H-S-H.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
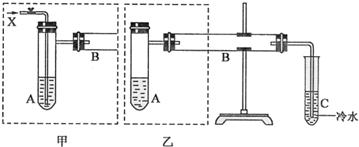
 化学实验有助于理解化学知识,提升科学素养.某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究.
化学实验有助于理解化学知识,提升科学素养.某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com