
氮化铝(AIN)是一种新型无机材料,广泛应用于集成电路生产领域。某化学研究小组利用氮气、氧化铝和活性炭制取氮化铝,设计下图实验装置。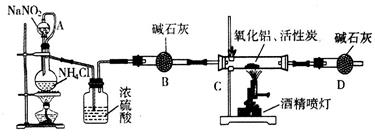
试回答:
(1)实验中用饱和NaNO2与 NH4C溶液制取氮气的化学方程式为 。
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A的作用是 (填写序号)。
a.防止NaNO2饱和溶液蒸发 b.保证实验装置不漏气 c.使NaNO2饱和溶液容易滴下
(3)按图连接好实验装置,检查装置气密性的方法是 。
(4)化学研究小组的装置存在严重问题,请说明改进的办法 。
(5)反应结束后,某同学用下图装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计)。已知:氮化铝和NaOH溶液反应生成Na[Al(OH)4]和氨气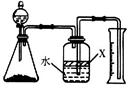 。
。
①广口瓶中的试剂X最好选用 (填写序号)。
a.汽油 b.酒精 c.植物油 d.CCl4
②广口瓶中的液体没有装满(上方留有空间),则实验测得NH3的体积将 (填“偏大”、“偏小”、“不变”)。
③若实验中称取氮化铝样品的质量为10.0g,测得氨气的体积为3.36L(标准状况),则样品中AlN的质量分数为 。
解析试题分析:(1)饱和NaNO2与 NH4C溶液制取氮气,则根据原子守恒可知,还应该有水和氯化钠生成,因此实验中用饱和NaNO2与 NH4C溶液制取氮气的化学方程式为NaNO2+MH4Cl NaCl+N2↑+2H2O。
NaCl+N2↑+2H2O。
(2)由于蒸馏烧瓶中有气体生成,压强大,分液漏斗中的液体不易滴下。分液漏斗与蒸馏烧瓶之间的导管A连接后,可以保持压强相同,使NaNO2饱和溶液容易滴下,答案选c。
(3)一般常用空气热胀冷缩法,因此根据该实验装置的特点可知,检查装置气密性的方法是在干燥管D末端连接一导管,将导管插入烧杯中的液面下,用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,说明气密性良好。
(4)由于氮气、氧化铝和活性炭制取氮化铝的同时,还有CO生成,所以必须有尾气处理装置,即在干燥管D末端连一尾气处理装置。
(5)①氮化铝和NaOH溶液反应生成Na[Al(OH)4]和氨气,所以要通过排水法测量氨气的体积,则根据氨气极易溶于水可知,X应该是密度小于水与水不溶的试剂。汽油易挥发,a不正确。酒精和水互溶,四氯化碳密度大于水,因此选项bd均不正确。植物油密度小于水、不溶于水,c正确,答案选c。
②广口瓶中的液体没有装满(上方留有空间),由于排除的水是依据压强差来完成的,所以对实验结果不影响,即则实验测得NH3的体积将不变。
③测得氨气的体积为3.36L(标准状况),氨气的物质的量是3.36L÷22.4L/mol=0.15mol,则根据氮原子守恒可知,氮化铝的物质的量是0.15mol,质量是0.15mol×41g/mol=6.15g,所以品中AlN的质量分数为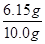 ×100%=61.5%。
×100%=61.5%。
考点:考查氮气的制备、装置作用与装置气密性检验、实验设计与评价、物质含量的测定与计算等


科目:高中化学 来源: 题型:实验题
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: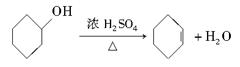
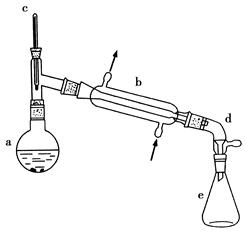
可能用到的有关数据如下:
| | 相对分子质量 | 密度 g/cm3 | 沸点/℃ | 溶解性 |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
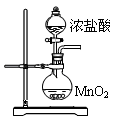
三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
| 实验步骤 | 实验现象 | 实验结论 |
| ① | | 溶液X中含有Na+ |
| ② | | 溶液X中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
(1)实验目的:验证SO2的氧化性。将胶头滴管中浓硫酸分别滴入 Y型管的两个支管中,所产生的两种气体相遇发生反应:SO2+2H2S=3S+2H2O,则在支管交叉处实验现象为 ,硫化亚铁处加水的目的是 。
(2)实验目的:探究 SO2与BaCl2反应生成沉淀的条件。SO2通入BaCl2溶液并不产生沉淀,再通入另一种气体后就产生了白色沉淀。常温下,若由右侧 Y型管产生另一种气体,则在其左右支管应放置的药品是 和 ,导气管A的作用是 。
(3)实验目的:铁镁合金中铁含量的测定。①读取量气管中数据时,若发现水准管中的液面高于量气管中液面,应采取的措施是 ;②若称得铁镁合金的质量为 0.080g,量气管中初读数为1.00mL,末读数为 45.80mL(已折算为标准状况),则合金中铁的百分含量为 (精确到0.01%)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如下: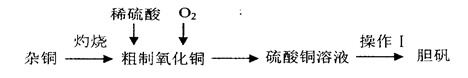
(1)操作I具体为__________、___________、过滤、烘干。
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是___________(填字母代号)。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气。反应完全后向其中加入过量_______________(填化学式,下同),调节pH至4,生成_________沉淀,过滤得硫酸铜溶液[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4]。
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O)。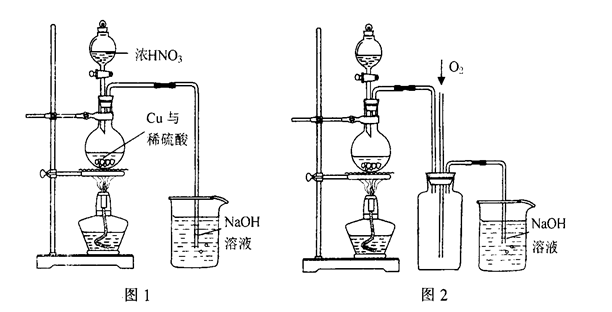
烧瓶内发生反应的离子方程式为____________________________________________;
图2是图1的改进装置,其优点有①__________________________,②_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br一、SO42一、Cl一等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程: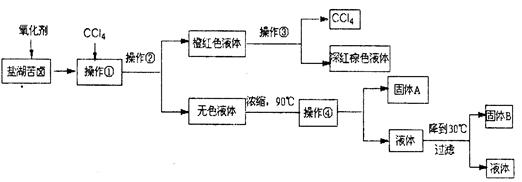
请根据以上流程,回答相关问题:
(1)操作②的所需的主要仪器是 。
(2)参照下图溶解度曲线,得到的固体A的主要成分是 (填化学式)。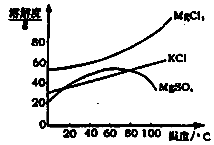
(3)同学甲提出一些新的方案,对上述操作②后无色溶液进行除杂提纯,其方案如下:
【有关资料】
| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |
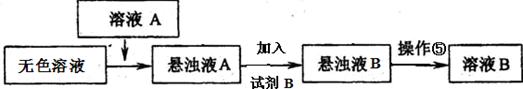
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
在没有现成的CO2气体发生器的情况下,请你选用下图所示部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置。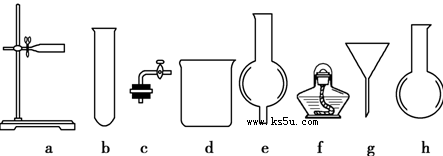
(1)应选用的仪器是________________(填入编号);
(2)若用上述装置制取CO2气体,而实验室只有稀硫酸、浓硝酸、水、块状纯碱、块状大理石,比较合理的方案,应选用的药品是________ _________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验操作正确且能达到预期目的的是( )
| | 实验目的 | 操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| ④ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| ⑤ | 比较确定铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
| ⑥ | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于各实验装置图的叙述中正确的是( )。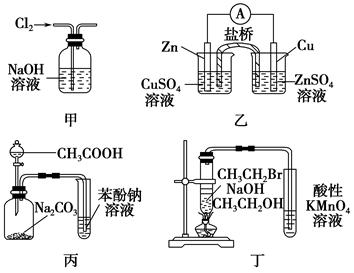
| A.图甲:除去Cl2中含有的少量HCl |
| B.图乙:构成锌—铜原电池 |
| C.图丙:根据实验现象推知酸性CH3COOH>H2CO3>C6H5OH |
| D.图丁:验证溴乙烷发生消去反应生成烯烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com