
【题目】将铝粉与某铁的氧化物FeO·2Fe2O3粉末配制成铝热剂,分成两等份。一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为3.92 L;另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为
A. 2.80 LB. 3.92 LC. 5.60 LD. 7.84 L
【答案】A
【解析】
分成两等份。一份直接放入足量的烧碱溶液中,只有铝与氢氧化钠发生反应生成氢气,3.92L为氢气的体积,根据氢气的体积可以计算出铝的物质的量。另一份在高温下恰好发生铝热反应,实质为铝置换出铁,铁的氧化物FeO2Fe2O3中的氧原子全部与铝结合生成氧化铝,利用氧原子守恒,根据铝的物质的量,计算出氧原子的物质的量,再结合氧化物FeO2Fe2O3的化学式计算出其物质的量,再根据铁原子守恒,可知生成的铁的物质的量。根据铁的物质的量计算铁与盐酸反应生成的氢气体积。
一份直接放入足量的烧碱溶液中,铝与氢氧化钠发生反应生成标准状况下的氢气3.92L,氢气的物质的量为![]() =0.175mol。铝热反应时,铁的氧化物FeO2Fe2O3中的氧原子全部与铝结合生成氧化铝,根据关系式3H2~2Al~3O~Al2O3,铝生成氧化铝结合的氧原子为0.175mol,根据氧原子守恒,氧化物FeO2Fe2O3的物质的量为
=0.175mol。铝热反应时,铁的氧化物FeO2Fe2O3中的氧原子全部与铝结合生成氧化铝,根据关系式3H2~2Al~3O~Al2O3,铝生成氧化铝结合的氧原子为0.175mol,根据氧原子守恒,氧化物FeO2Fe2O3的物质的量为![]() =0.025mol。
=0.025mol。
根据铁原子守恒,另一份生成的铁的物质的量为:0.025mol×5=0.125mol。根据Fe~H2可知,0.125molFe可生成氢气0.125mol,所以另一份生成的氢气的体积为0.125mol×22.4L/mol=2.8L,故选A。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“ 0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2-3次;
请回答下列问题:
(1)以上步骤有错误的是(填编号)_____________,该错误操作会导致测定结果_________ (填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用________________ (填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果____________(填“大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视_______________________;判断到达滴定终点的依据是_______。
(4)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.10 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.22 |
从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是(______)
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视读数
(5)根据上表记录数据,通过计算可得,该盐酸浓度为____________mol·L-1
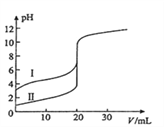
(6)室温下,用0.100mol/L NaOH溶液分别滴定20.00mL0.100mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是(______)
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗V(NaOH)小于20mL
C.V(NaOH) =20mL时,c( Cl- )=c(CH3COO- )
D.V(NaOH) =10mL时,醋酸溶液中:c( Na+ )> c(CH3COO-)> c( H+ )> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为几种晶体或晶胞的示意图:
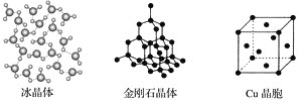
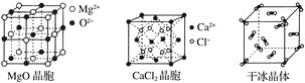
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是____。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为:___。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能___(填“大于”或“小于”)MgO晶体,原因是____。
(4)每个Cu晶胞中实际占有___个Cu原子,CaCl2晶体中Ca2+的配位数为__。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂、漂白剂,主要用于亚麻、纸浆等漂白。NaClO2在溶液中可生成ClO2、HClO2、ClO2-、Cl-等含氯微粒,经测定,25 ℃时各组分含量随pH变化情况如图所示(部分没有画出)。则下列分析不正确的是

A. 亚氯酸钠在碱性条件下较稳定
B. 25 ℃时,HClO2的电离平衡常数Ka=10-6
C. 25 ℃,pH=3时NaClO2溶液中c(Na+)+c(H+)=c(ClO2-)+c(OH-)
D. 等浓度的HClO2溶液和NaClO2溶液等体积混合的溶液中(pH<7):c(ClO2-)>c(Na+)>c(HClO2)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某一元弱酸HA的电离常数![]() 。 向
。 向![]() 浓度约为
浓度约为![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的标准NaOH溶液,其pH变化曲线如图所示
的标准NaOH溶液,其pH变化曲线如图所示![]() 忽略温度变化
忽略温度变化![]() 。请回答下列有关问题:
。请回答下列有关问题:

(1)a、b、c、d四点中水的电离程度最大的是________点,滴定过程中宜选用__________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视______________________,滴定终点的现象为_____________________________________________________。
(3)若滴定结束时,滴定管中的液面如图所示,则其读数为___________mL。

(4)滴定过程中部分操作如下,下列各操作使测量结果偏高的是____________(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(5)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_____![]() 。
。
实验序号 | NaOH溶液体积 | 待测HA溶液体积 |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:

(1)煅粉主要含MgO和________,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,若溶液Ⅰ中c(Mg2+)小于5×10-6mol·L-1,则滤液pH大于________[Mg(OH)2的Ksp=5×10-12];该工艺中不能用(NH4)2SO4代替NH4NO3,原因是______________。
(2)滤液Ⅰ中的阴离子有________(忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成________,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为_________。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式________。
(5)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其他离子不参与电极反应,放电时负极Al的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:Al3++4NH3·H2O![]() AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B. 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-![]() CaCO3↓+H2O
CaCO3↓+H2O
C. 碳酸钙溶于醋酸:CaCO3+2H+![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
D. 氯化亚铁溶液中通入氯气:2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的有( )个
①20℃,101kPa,22.4LCl2通入足量的NaOH溶液充分反应,有NA个电子转移
②64g灼热的铜丝在硫黄蒸气里完全反应后,失去的电子数为2NA
③标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4 L
④7.8g Na2S与Na2O2的混合物中阴离子数大于0.1NA
⑤0℃,101kPa,含有lmol硫原子的SO2与SO3的混合物,其体积小于22.4L
⑥常温常压下,17g甲基(-14CH3)所含的中子数为9NA
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com