
NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2L的戊烷所含的分子数大于0.5NA
B. 28g乙烯所含共用电子对数目为4NA
C. 标准状况下,11.2 L二氯甲烷所含分子数为0.5NA
D. 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为2NA
科目:高中化学 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:选择题
制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是烧杯中( )
A. 有铜无铁 B. 有铁无铜 C. 铁、铜都有 D. 铁、铜都无
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:推断题
化合物F是合成抗过敏药孟鲁斯特钠的重要中间体,其合成过程如下:
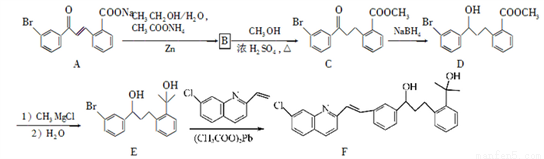
请回答下列问题:
(1)化合物C中含有氧官能团为________、________(填名称)。
(2)化合物B的分子式为C16H13O3Br,B的结构简式为________。
(3)由C→D、E→F的反应类型依次为________、________。
(4)写出符合下列条件C的一种同分异构体的结构简式________。
Ⅰ、属于芳香族化合物,且分子中含有2个苯环
Ⅱ、能够发生银镜反应
Ⅲ、分子中有5种不同环境的氢原子.
(5)已知:RCl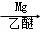 RMgCl,写出CH3CH2OH、
RMgCl,写出CH3CH2OH、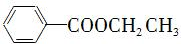 为原料制备
为原料制备 的合成路线流程图(乙醚溶剂及无机试剂任用);________
的合成路线流程图(乙醚溶剂及无机试剂任用);________
合成路线流程图示例如下:H2C=CH2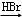 CH3CH2Br
CH3CH2Br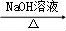 CH3CH2OH.
CH3CH2OH.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省长沙市高二下学期第一次模块检测化学试卷(解析版) 题型:简答题
Ⅰ.工业合成氨与制备硝酸一般可连续生产,回答下列问题:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2。T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_______(填计算结果)。
CO2+H2。T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_______(填计算结果)。
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:________________________________ 。
(3)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为____________________。
Ⅱ.甲醇是一种重要的有机化工原料,可用于制取甲醚。一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+ H2O(g)。
CH3OCH3(g)+ H2O(g)。
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
II | 387 | 0.40 | a | b |
III | 207 | 0.20 | 0.090 | 0.090 |
(4) 容器I中的反应达到平衡时所需的时间_______(填“大于”“小于”或等于)容器II中的。
(5) a=_____
(6) 下列说法中能说明该反应达到平衡状态的是__________。(填字母)
A. 容器中压强不变 B. 混合气体中c(CH3OCH3) 不变
C. 混合气体的密度不变 D. 单位时间内生成1 mol CH3OCH3 同时消耗2molCH3OH
(7)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g)  CH3OH(g) ΔH=-m kJ·mol-1
CH3OH(g) ΔH=-m kJ·mol-1
反应②:2CO(g)+4H2(g)  CH3OCH3(g)+H2O(g) ΔH= -n kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -n kJ·mol-1
则下列m与n的关系中,正确的是__________(填字母)。
A. n﹥2m B. m﹥2 n C. 2m﹥n D. m﹥3n
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省长沙市高二下学期第一次模块检测化学试卷(解析版) 题型:选择题
某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2、②Cl2、③CH4、④HCl、⑤NH3、⑥NO、 ⑦NO2、⑧SO2,下列操作正确的是( )
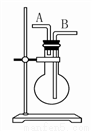
A. 烧瓶是干燥的,由A进气收集①③⑤
B. 烧瓶是干燥的,由B进气收集②④⑥⑦⑧
C. 在烧瓶中充满水,由A进气收集①③⑤⑦
D. 在烧瓶中充满水,由B进气收集⑥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省长沙市高二下学期第一次模块检测化学试卷(解析版) 题型:选择题
已知某酸性溶液中含有Ba2+、Fe3+,则下列能与上述离子共存的离子组是( )
A. CO32﹣、SO42﹣、NH4+、Na+ B. Cl﹣、SCN﹣、NO3﹣、Cu2+
C. Br﹣、I﹣、Mg2+、Na+ D. H+、Cl﹣、NO3﹣、Al3+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高一下学期分班考试化学试卷(解析版) 题型:选择题
已知将盐酸逐滴加入Na2CO3中,发生的反应依次为:HCl+ Na2CO3= NaHCO3+NaCl, NaHCO3+HCl =NaCl+H2O+CO2↑;现将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
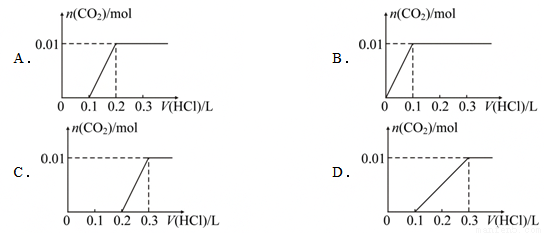
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届江西省协作体高三下学期第一次联考理综化学试卷(解析版) 题型:填空题
甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)反应②是________________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。则平衡状态由A变到B时,平衡常数K(A)_____________K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。
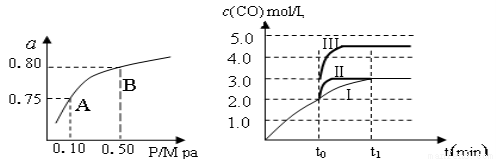
(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如右上图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_____________________。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________________。
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。

请写出加入(通入)b物质一极的电极反应式_________________;
每消耗6.4g甲醇转移的电子数为_______________。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高二上学期开学检测化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. 酯类物质是形成水果香味的主要成分
B. 可用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
C. 乙酸乙酯、油脂与烧碱溶液反应均有醇生成
D. 可向蔗糖的水解液中直接加入银氨溶液检验蔗糖是否发生水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com