
【题目】庆祝新中国成立 70 周年阅兵式上,“东风-41 洲际弹道导弹”“歼 20”等护国重器闪耀亮相,它们都采用了大量合金材料。
回答下列问题:
(1)某些导弹的外壳是以碳纤维为增强体,金属钛为基体的复合材料。基态钛原子的外围电子排布式为_____。钛可与 C、N、O 等元素形成二元化合物,C、N、O 元素的电负性由大到小的顺序是_________。
(2)钛比钢轻,比铝硬,钛硬度比铝大的原因是_____。
(3)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中阴离子的立体构型为_____,S 的_____杂化轨道与 O 的 2p 轨道形成_____键(填 “π”或“σ”)。
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为_____(填字母序号)。

(5)氮化钛熔点高,硬度大,其晶胞结构如图所示。

若氮化钛晶体中 Ti 原子的半径为 a pm,N 原子的半径为 b pm,则氮化钛晶体中原子的空间利用率的计算式为_____(用含 a、b 的式子表示)。碳氮化钛化合物在航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式为_____。
【答案】3d24s2 O>N>C Ti 原子的价电子数比 Al 多,金属键更强 正四面体形 sp3 σ D  ×100% Ti4CN3
×100% Ti4CN3
【解析】
(1)基态钛原子的电子排布式为1s22s22p63s23p63d24s2,由此可确定外围电子排布式。C、N、O 元素的非金属性关系为O>N>C,电负性的关系与非金属性关系相同。
(2)钛硬度比铝大,从金属键的大小找原因。
(3)钛镍合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中阴离子为SO42-,S 的价层电子对数为4,由此可确定其立体构型和S的杂化方式,S的杂化轨道与 O 的 2p 轨道头对头重叠。
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为![]() ,由此确定符合题意的图形。
,由此确定符合题意的图形。
(5)在氮化钛晶胞中,含Ti原子的个数为12×![]() +1=4,含N原子个数为8×
+1=4,含N原子个数为8×![]() +6×
+6×![]() =4,由此可求出原子的总体积,再由原子半径求晶胞的总体积,便可求出氮化钛晶体中原子的空间利用率的计算式。碳氮化钛化合物结构是用碳原子代替氮化钛晶胞顶点的氮原子,则晶胞中有1个N原子换成1个C原子,Ti原子个数不变,由此确定这种碳氮化钛化合物的化学式。
=4,由此可求出原子的总体积,再由原子半径求晶胞的总体积,便可求出氮化钛晶体中原子的空间利用率的计算式。碳氮化钛化合物结构是用碳原子代替氮化钛晶胞顶点的氮原子,则晶胞中有1个N原子换成1个C原子,Ti原子个数不变,由此确定这种碳氮化钛化合物的化学式。
(1)基态钛原子的电子排布式为1s22s22p63s23p63d24s2,由此可确定外围电子排布式为3d24s2。C、N、O 元素的非金属性关系为O>N>C,则电负性:O>N>C。答案为:3d24s2;O>N>C;
(2)钛和铝都形成金属晶体,应从离子的带电荷分析钛硬度比铝大,其原因是Ti 原子的价电子数比Al多,金属键更强。答案为:Ti 原子的价电子数比 Al 多,金属键更强;
(3)钛镍合金溶于热的硫酸生成Ti(SO4)2、NiSO4,其中阴离子为SO42-,S 的价层电子对数为4,由此可确定其立体构型为正四面体形,S的杂化方式为sp3,S的杂化轨道与 O 的 2p 轨道头对头重叠,从而形成σ键。答案为:正四面体形;sp3;σ;
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为![]() ,由此确定符合题意的图形为D。答案为:D;
,由此确定符合题意的图形为D。答案为:D;
(5)在氮化钛晶胞中,含Ti原子的个数为12×![]() +1=4,含N原子个数为8×
+1=4,含N原子个数为8×![]() +6×
+6×![]() =4,由此可求出原子的总体积为
=4,由此可求出原子的总体积为![]() ,再由原子半径求晶胞的总体积为(2a+2b)3,便可求出氮化钛晶体中原子的空间利用率的计算式为
,再由原子半径求晶胞的总体积为(2a+2b)3,便可求出氮化钛晶体中原子的空间利用率的计算式为 。碳氮化钛化合物结构是用碳原子代替氮化钛晶胞顶点的氮原子,则晶胞中有1个N原子换成1个C原子,Ti原子个数不变,由此确定这种碳氮化钛化合物的化学式为Ti4CN3。答案为:
。碳氮化钛化合物结构是用碳原子代替氮化钛晶胞顶点的氮原子,则晶胞中有1个N原子换成1个C原子,Ti原子个数不变,由此确定这种碳氮化钛化合物的化学式为Ti4CN3。答案为: ;Ti4CN3。
;Ti4CN3。


科目:高中化学 来源: 题型:
【题目】以赤铁矿(主要成分为60.0%Fe2O3,杂质为3.6%FeO,Al2O3,MnO2,CuO等)为原料制备高活性铁单质的主要生产流程如图所示:

已知部分阳离子以氢氧化物形式完全沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Cu(OH)2 |
pH | 3.4 | 5.2 | 9.7 | 6.7 |
请回答下列问题:
(1)含杂质的赤铁矿使用前要将其粉碎,目的是___。操作Ⅰ的名称是___。
(2)将操作Ⅰ后所得的MnO2与KClO3、KOH溶液混合共热,可得到K2MnO4,此反应的化学方程式是____。
(3)将pH控制在3.6的目的是___。已知25℃时,Ksp[Cu(OH)2]=2×10-20,该温度下反应Cu2++2H2O![]() Cu(OH)2+2H+的平衡常数K=___。
Cu(OH)2+2H+的平衡常数K=___。
(4)加入双氧水时反应的离子方程式为___。
(5)利用氨气在500℃以上分解得到的氮原子渗透到铁粉中可制备氮化铁(FexNy),若消耗氨气17.0g,消耗赤铁矿石1kg,写出该反应完整的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
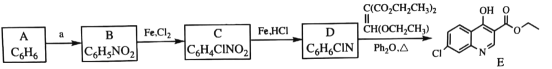
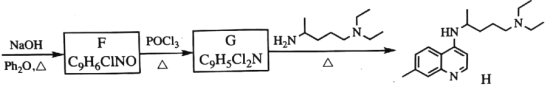
【题目】盐酸美西律(E)是一种抗心律失常药,其一条合成路线如下:

回答下列问题:
(1)已知A的分子式为![]() ,其化学名称为______。
,其化学名称为______。
(2)B中的官能团的名称为_________。
(3)由A生成C的化学反应方程式为________,反应类型是_________。
(4)由D的结构可判断:D应存在立体异构。该立体异构体的结构简式为______。
(5)若用更为廉价易得的氨水替代盐酸羟氨![]() 与C反应,生成物的结构简式为______。
与C反应,生成物的结构简式为______。
(6)A的同分异构体中能与三氯化铁溶液发生显色反应的还有__种;其中,核磁共振氢谱为四组峰,峰面积比为6∶2∶1∶1的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹是一种抗疟疾药物, 研究发现,该药在细胞水平上能有效抑制新型冠状病毒的感染。其合成路线如下:
已知:
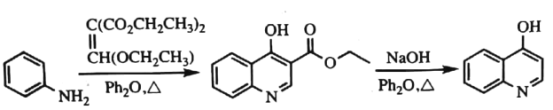
回答下列问题:
(1)A是一种芳香经, B 中官能团的名称为__________________。
(2)反应 A→B 中须加入的试剂a 为___________________。
(3)B 反应生成 C 的反应化学反应方程式是______________________。
(4)C→D 反应类型是_________, D的结构简式为_______________。
(5)F→G反应类型为________________。
(6)I是E的同分异构体,与E 具有相同的环状结构, 写出任意一种符合下列条件的I的结构简式是__________________________。
①I是三取代的环状有机物, 氯原子和羟基的取代位置与E相同;
②核磁共振氢谱显示I 除了环状结构上的氢外,还有4组峰, 峰面积比3:1:1:1;
③I加入NaHCO3溶液产生气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。
(1)该反应的离子方程式为__________________________。
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
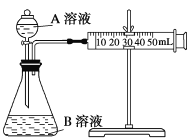
序号 | A溶液 | B溶液 |
① | 2 mL 0.1 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
② | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
③ | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
该实验探究的是______对化学反应速率的影响。在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是____________(用实验序号填空)。
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。取两支试管各加入2 mL 0.1 mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验目的是研究_________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
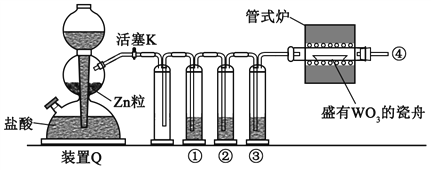
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为![]() 的有机物A有下列变化:
的有机物A有下列变化:

其中B、C的相对分子质量相等,下列有关说法错误的是( )
A.C和E互为同系物
B.符合题目条件的A共有4种
C.D既能发生氧化反应,又能发生还原反应
D.符合题目条件的B共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A(分子式C6H10O3)是合成某种隐形眼镜材料的单体,A可发生如下变化:

已知:Ⅰ.物质B是最简单的二元醇,可用作汽车发动机抗冻剂;物质D不能发生银镜反应,但能与NaHCO3溶液反应放出气体。
Ⅱ.![]()
回答下列问题:
(1)隐形眼镜材料的结构简式为______________________;
(2)写出物质B在铜催化下与O2反应的化学方程式_____________________;
(3)与C互为同分异构体,分子为链状的酯类物质共有____________种;
(4)请设计合理方案,用物质D制取乙二酸(其他无机原料自选,用反应流程图表示,并注明必要的反应条件)____________;。
例如:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com