
合成尿素的反应2NH3(g)+CO2(g)=CO(NH2)2(尿素)+H2O(l) △H<0 分两步进行:①2NH3(g)+CO2(g)→NH4COONH2(s) △H1<0 ②NH4COONH2(s) →CO(NH2)2(尿素)+H2O(l) △H2>0。下列示意图中,能正确表示合成尿素过程中能量变化的是( )
A.  B.
B.  C.
C.  D.
D. 
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(五)化学 试卷(解析版) 题型:实验题
实验室用NaClO3与Na2SO3制取ClO2气体,再由ClO2在强碱性条件下与过量的H2O2反应制得漂白剂NaClO2(装置如下图所示)。

已知:
(I)NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO3·3H2O,高于38℃时析出晶体是NaClO2;
(Ⅱ)30 % H2O2超过40℃时会完全分解;
(Ⅲ)高于60℃时NaClO2分解成NaClO3和NaCl。

(1)装置A发生的反应中,还原剂是________。
(2)①装置B中反应生成NaClO2的化学方程式为____________。
②实验中B装置需进行温度控制不超过40℃,在不改变NaOH溶液浓度和体积的条件下,可采取的措施有________、_______。
(3)请补充从装置B反应后的溶液中获得NaClO2晶体的操作步骤。
①在55 ℃时蒸发结晶;②_______;③ ________;④________;得到成品。
(4)装置C的作用是______________。
(5)证明实验后装置B所得混合溶液中的NaClO2具有氧化性的实验方案是________。(可供选用的试剂:稀H2SO4、FeCl2溶液、KSCN溶液)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省、惠安一中、泉州实验中学高一上学期期末联考化学试卷(解析版) 题型:选择题
某同学对一无色透明溶液进行分析得出该溶液中含有下列某组离子,你认为该组离子应该是 ( )
A.Al3+、NO3―、K+、SO42ˉ B.Ca2+、H+、CO32ˉ、AlO2―
C.OHˉ、SO42ˉ、NH4+、Al3+ D.Fe3+、Mg2+、NO3ˉ、Clˉ
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一下学期第一次(3月)阶段检测化学试卷(解析版) 题型:填空题
(1)一种新型的熔融盐燃料电池具有高发电效率而备受重视。现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气和CO2的混合气体,制得燃料电池。该电池工作时的负极反应式为_____________; 熔融盐中CO32-的物质的量在工作时__ (填“增大”、“减少”、“不变”)。
(2)如下图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液见图。关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源a端为_____极,通电一段时间后,观察到滤纸d 端出现的现象是:___________;
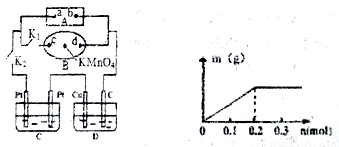
己知C装置中溶液为Cu(NO3)2和X(NO3)2,且均为0.1mol, D装置中的溶液为CuSO4溶液,打开K1,关闭K2,通电一段时间后,C装置阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如右图所示。则Cu2+、X3+氧化能力由大到小的顺序是__ ;D装置C 极的电极反应式为____________。
(3)最近,又有科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸汽。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2—离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油,①电池的正极反应式为________;②放电时固体电解质里的O2-离子的移动方向是向_______极移动(填正或负)。
(4)某同学利用反应Cu+2H+=Cu2++H2↑设计实验来制取氯化铜溶液。该同学设计的装置应该为______。(填“原电池”或“电解池”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一下学期第一次(3月)阶段检测化学试卷(解析版) 题型:选择题
金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一下学期第一次(3月)阶段检测化学试卷(解析版) 题型:选择题
下列反应属于放热反应的是
A. C与水蒸气在高温下反应制取水煤气 B. CO2与C在高温下进行反应
C. 加热分解碳酸钙 D. 钠与水的反应
查看答案和解析>>
科目:高中化学 来源:河南省南阳市2016-2017学年高二下学期第一次月考(3月)化学试卷 题型:选择题
某有机物如右图。下列说法不正确的是( )
A. 该有机物属于饱和烷烃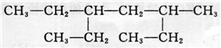
B. 该烃的名称是3—甲基—5—乙基庚烷
C. 该烃与2,5—二甲基—3—乙基己烷互为同系物
D. 该烃的一氯取代产物共有8种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二开学质检(3月)化学试卷(解析版) 题型:简答题
在2L带气压计的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:2X(g)+Y(g) 2Z(g); ΔH <0若达到平衡时Z的物质的量浓度为0.45 mol•L-1。请回答下列问题。
2Z(g); ΔH <0若达到平衡时Z的物质的量浓度为0.45 mol•L-1。请回答下列问题。
(1)若反应经历5min达到平衡,则Y的平均反应速率为____________。
(2)相同条件下进行反应,在t 1 时刻,只改变下列某一种条件,其曲线图像如图甲。若c=0.90mol,t 1 时刻改变的条件是_________(填选项编号,A.升温 B.降温 C.加压 D.减压 E.加催化剂),t 2 _______5min (填“>”,“<”或“=”)。

(3)在粗制CuSO4•5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适的氧化剂,使Fe2+氧化为Fe3+,下列物质可选用的是:__________
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②已知某温度下Fe (OH)3的溶度积Ksp=1.0×10-38,通常认为残留在溶液中的离子浓度小于1.0×10-5mol•L-1时就认为沉淀完全,则Fe3+完全沉淀时溶液的pH=______________。
(4)常温下0.1 mol•L-1的CH3COOH溶液加水稀释过程中,下列各项数值一定变小的是___________
A.c(H+) B.c(H+)/ c(CH3COOH)
C.c(H+)•c(OH-) D.c(OH-)/ c(H+)
(5)一定温度下,在一固定容积的密闭容器中,可逆反应A(g)+2B(g) 4C(g)ΔH>0,达平衡时,c(A)=2mol•L-1,c(B)=7mol•L-1,c(C)=4mol•L-1,试确定B的起始浓度c(B)的取值范围是____________。
4C(g)ΔH>0,达平衡时,c(A)=2mol•L-1,c(B)=7mol•L-1,c(C)=4mol•L-1,试确定B的起始浓度c(B)的取值范围是____________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三3月联考理科综合化学试卷(解析版) 题型:实验题
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定

① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)若将H2换成CO,则还需补充 装置。
(3)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
Ⅱ.铁矿石中含铁量的测定

(1)步骤④中煮沸的作用是 。
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(3)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测夜润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色,再读数
(4)若滴定过程中消耗0.5000mol·L?1的KI溶液20.00mL,则铁矿石中铁的百分含量为 。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com