
| ||
| ||
| 44x |
| 12 |
| 44y |
| 100 |
| 44x |
| 12 |
| 44y |
| 100 |
| 12 |
| 100 |
| 21+100×12% |
| 21+100 |


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
| A、25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B、由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
| C、标准状况下,22.4L乙烷中共价键数目为6NA |
| D、1L 0.2mol?L-1 CH3COONa溶液与1L 0.1mol?L-1 CH3COONa溶液相比,CH3COO-数目之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(NO3)3溶液中加入过量的HI溶液的反应为:2Fe3++2I-═2Fe2++I2 |
| B、在氨水中通入过量SO2的反应为:2NH3?H2O+SO2═2NH4++SO32-+H2O |
| C、将足量CO2通入含Cl-、CO32-、NO3-、NH4+的溶液中无明显现象 |
| D、碱性溶液中,Na+、Ba2+、ClO-、SO32-可以大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 砷化镓为第三代半导体材料,晶胞结构如图所示,
砷化镓为第三代半导体材料,晶胞结构如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 乙酰水杨酸俗称阿司匹林(
乙酰水杨酸俗称阿司匹林(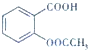 ),是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
),是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为: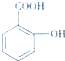 +(CH3CO)2O
+(CH3CO)2O| 浓硫酸 |
| 85℃-90℃ |
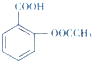 +CH3COOH
+CH3COOH| 浓硫酸 |
| 摇匀 |
| 85℃-90℃加热 |
| 冷却 |
| 减压过滤 |
| 洗涤 |
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
| 乙酸乙酯 |
| 沸石 |
| 加热 |
| 回流 |
| 趁热过滤 |
| 冷却 |
| 减压过滤 |
| 洗涤 |
| 干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com