


 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ʡ������ѧ2012��������Ĵ��¿���ѧ���� ���ͣ�022
��ϸ��ұ��������ijЩϸ���������л���ܿ��ɽ�����ʯ��������Һ��������˾������ÿ����е�������������(��Ҫ�ɷ�FeS2)����ΪFe2(SO4)3����ʹ��Һ������ǿ������Fe2(SO4)3���������ܽ��ͭ��ʯ(��Ҫ�ɷ�Cu2S)��Ȼ�������м��һ���õ�ͭ����������ͼ��
(1)�������������̵Ļ�ѧ��Ӧ����ʽΪ________��
(2)����ܽ��ͭ��ʯ(Cu2S)�ͽ�һ���õ�ͭ�����ӷ�Ӧ����ʽ��
��________Cu2S��________Fe3+��________H2O![]() ________Cu2+��________Fe2+��________(����)��________SO42��
________Cu2+��________Fe2+��________(����)��________SO42��
��________��
(3)��ҵ���Ի�ͭ��Ϊԭ�ϣ���ȡ��������������ͭ���ù����������·�Ӧ��
2Cu2S(s)��3O2(g)![]() 2Cu2O(s)��2SO2(g)����H��m kJ/mol
2Cu2O(s)��2SO2(g)����H��m kJ/mol
2Cu2O(s)��Cu2S(s)![]() 6Cu(s)��SO2(g)����H��n kJ/mol
6Cu(s)��SO2(g)����H��n kJ/mol
��Cu2S(s)��O2(g)![]() 2Cu(s)��SO2(g)����H��________��
2Cu(s)��SO2(g)����H��________��
�ù�����ͭ�ĸ���ƷSO2���������ᣬSO2ת��ΪSO3�ķ�ӦΪ��2SO2(g)��O2(g)![]() 2SO3(g)���÷�Ӧ��ƽ�ⳣ������ʽΪK��________��
2SO3(g)���÷�Ӧ��ƽ�ⳣ������ʽΪK��________��
(4)������ϸ��ұ����ŵ�________(˵һ�㼴��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ�����и������в��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
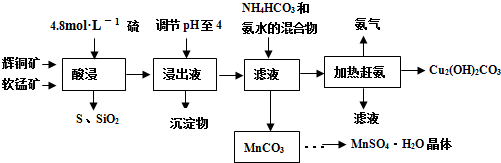
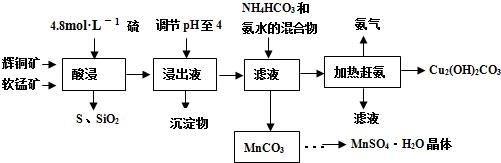
��ͭ����Ҫ�ɷ�Cu2S�����̿���Ҫ�ɷ�MnO2�����Ƕ���������SiO2��Fe2O3�����ʡ���ҵ���ۺ����������ֿ����Ʊ������̺ͼ�ʽ̼��ͭ����Ҫ�����������£�

��֪����MnO2�ܽ����������е�������Ϊ������
��[Cu(NH3)4]SO4�����ȶ�������ˮ�л�ֽ�����NH3��
�۲��ֽ������������������������ ��pH��Χ���±���ʾ����ʼ������pH����������Ũ��Ϊ1.0 mol��L-1���㣩��
|
|
��ʼ������pH |
������ȫ��pH |
|
Fe3�� |
1.1 |
3.2 |
|
Mn2�� |
8.3 |
9.8 |
|
Cu2�� |
4.4 |
6.4 |
��1�����ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ�� ����дһ�㣩��
��2�����ʱ���õ��Ľ���Һ����Ҫ����CuSO4��MnSO4�ȡ�
д���÷�Ӧ�Ļ�ѧ����ʽ ��
��3�����ڽ���ҺpH�ķ�ΧΪ ����Ŀ���� ��
��4���������п�ѭ��ʹ�õ������� ��д��ѧʽ����
��5���ڸù��յġ��������������ڣ������ȵ��¶ȹ��ͻ���ߣ�������� �Ľ����
��6���ñ�BaCl2��Һ�ⶨ��Ʒ��MnSO4��H2O��������ʱ��������Ʒ���ȴ���100%���ⶨ�����в��������ɺ��ԣ��������ԭ���� (��дһ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡ�¿��� ���ͣ������

 ___Cu2����___Fe2����______��___SO42-
___Cu2����___Fe2����______��___SO42- 2SO3(g)���÷�Ӧ��ƽ�ⳣ������ʽΪK=_______
2SO3(g)���÷�Ӧ��ƽ�ⳣ������ʽΪK=_______�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com