
����Ŀ��ijͬѧΪ̽��Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飮
��1�����ơ������ظ� 1mol �ֱ�Ͷ�뵽��������ͬŨ�ȵ������У���Ԥ��ʵ������������ ��Ӧ����ҵĵ����� �� �����ᷴӦ���������������� ��
��2���� Na2S ��Һ��ͨ���������ֻ�ɫ���ǣ���֤�� Cl �ķǽ����Ա� S ǿ����Ӧ���ӷ���ʽ Ϊ ��
��3��������ͼװ�ÿ���֤ͬ����Ԫ�طǽ����Եı仯���ɣ����� A ������Ϊ �� װ�� D ������Ϊ�� 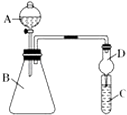
����Ҫ֤���ǽ����ԣ�Cl��I���� A �м�Ũ���ᣬB �м� KMnO4��KMnO4��Ũ���᳣���·�Ӧ������������C �мӵ��۵⻯�ػ����Һ���۲쵽 C ����Һ��������֤�����ӻ��������Ĺ۵㿼�ǣ���װ��ȱ��β������װ�ã�������Һ����β����
����Ҫ֤���ǽ����ԣ�C��Si������ A �м����ᡢB �м� CaCO3��C �м� Na2SiO3 ��Һ���۲쵽 C ����Һ��������֤�������е�ͬѧ��Ϊ������лӷ��ԣ��ɽ��� C �и���ʵ�飬Ӧ����װ�ü�����װ����Һ��ϴ��ƿ��
���𰸡�
��1���أ���
��2��S2��+Cl2�TS��+2Cl��
��3����Һ©������ֹ������������NaOH���а�ɫ�������ɣ�����NaHCO3
���������⣺��1������������˳��Ϊ���أ��ƣ�þ������������ͬ�����������ᷴӦ��ҵ��Ǽأ�����1mol������Ҫ�õ�2mol���ӣ�1mol�ء��ƶ�ʧȥ1mol���ӣ�1molþʧȥ2mol���ӣ���1mol��ʧȥ3mol���ӣ������������������ǽ����������Դ��ǣ��أ�������2������������ǿ�����ʣ����������ܹ��������ӷ�Ӧ������Ӧ�����ӷ���ʽΪ��S2��+Cl2�TS��+2Cl�� �� ���Դ��ǣ�S2��+Cl2�TS��+2Cl������3������AΪ��Һ©�������θ����D�ܹ���ֹ���������Ա���C��Һ�������ƿ�У����Դ��ǣ���Һ©������ֹ������
��KMnO4��Ũ���᳣���·�Ӧ���������������ܹ��������������ɵⵥ�ʣ��ⵥ���������۱����ɫ��������һ���ж����壬�������β�����գ������ܹ�������������Һ��Ӧ������ʹ������������Һ���ն�������������Դ��ǣ�������NaOH�����Ȼ�����лӷ��ԣ�����ʵ��������Ҫ��������̼�е��Ȼ�������������Ȼ�����̼�����Ʒ�Ӧ����������̼����Ӧ��������B��C֮������װ�б���NaHCO3��Һ��ϴ��ƿ�����Դ��ǣ��а�ɫ�������ɣ�����NaHCO3 ��
�����㾫����������Ĺؼ���������ǽ�����Ԫ�����ڱ��е�λ�ü������ʵݱ�Ĺ��ɵ����֪ʶ��������Ŀǰ��֪��112��Ԫ���У��ǽ���Ԫ����22�֣���H��ǽ���Ԫ�ض�λ�����ڱ������Ϸ���H�����Ϸ�����F�Ƿǽ�������ǿ��Ԫ�أ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����ϩ�ͱ��������У�������ǣ� ��
A. ��ϩ�ܷ����Ӿ۷�Ӧ B. ��ϩ����ȼ��
C. ����ʹ���Ը��������Һ��ɫ D. ��������6��̼̼��ѧ����ȫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����X��Al2O3��Fe2O3��Cu��SiO2�е�һ�ֻ���������ɣ�ijУ������ȤС��������;���ֱ��X��������ʵ��̽���� ;��a�� 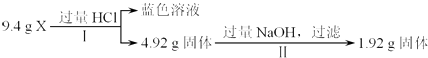
;��b�� 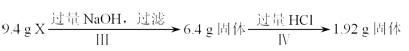
�����й�˵������ȷ���ǣ� ��
A.1.92g����ֻ��Cu
B.�ɢ��֪X��һ������Fe2O3��Cu
C.ԭ�������m��Fe2O3����m��Cu��=1��1
D.ԭ�����X���ٺ�Al2O3��SiO2�е�һ�֣������ܽ�һ��ȷ�϶��ߵĴ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1��7��10��5molL��1 | K1=4��4��10��7molL��1 K2=5��6��10��11molL��1 | 3��0��10��8 molL��1 |
��ش��������⣺
��1��ͬŨ�ȵ�CH3COO����HCO3����CO32����ClO�����H+��������ǿ������˳��Ϊ_____��
��2��������0��1molL��1��CH3COOH��Һ�ڼ�ˮϡ�����У����б���ʽ������һ����С����_______������ĸ��ţ���ͬ����
A��c��H+�� B��![]() C��c��H+��c��OH����
C��c��H+��c��OH����
D��![]() E��
E�� 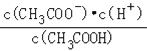
�����߸���Һ�¶ȣ������Ǵ���ӷ���������5�ֱ���ʽ�������������_____��
��3�����Ϊ10mL pH=2�Ĵ�����Һ��һԪ��HX��Һ�ֱ��ˮϡ����1000mL��ϡ����pH�仯��ͼ����HX�ĵ���ƽ�ⳣ��_____��������������������������С�����������ƽ�ⳣ����ϡ�ͺ�HX��Һ��ˮ���������c��H+��_____��������������������������С�������������Һ��ˮ���������c��H+����������_____��

��4����֪100��ʱ��ˮ�����ӻ�Ϊ1��10��12�����¶��²��ij��ҺPH=7������Һ��_____�����������������������������ԣ������¶���PH=1��H2SO4��ҺaL��PH=11��NaOH��ҺbL��ϣ������û��ҺPH=2����a��b=_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ������ ��
A. 0.1mol��L��1��ˮ�У�c(OH��)=c(NH4+)
B. 10 mL 0.02mol��L��1HCl��Һ��10 mL 0.02mol��L��1Ba(OH)2��Һ��ֻ��,����Ϻ���Һ�����Ϊ20 mL������Һ��pH=11
C. ��0.1mol��L��1CH3COONa��Һ�У�c(OH��)=c(CH3COOH)��c(H+)
D. 0.1mol��L��1ij��Ԫ����ǿ����NaHA��Һ�У�c(Na��)=2c(A2��)��c(HA��)��c(H2A)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ1Ϊ�����O2���ɵ�ȼ�ϵ��ʾ��ͼ���������ҺΪKOH��Һ��ͼ2Ϊ���AlCl3��Һ��װ�ã��缫���Ͼ�Ϊʯī���ø�װ�ý���ʵ�飬��Ӧ��ʼ��۲쵽x�缫�������ְ�ɫ����������˵����ȷ����
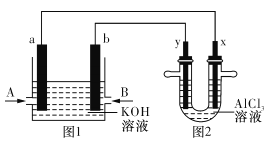
A. b�缫Ϊ����
B. ͼ1�е������Һ��pH����
C. a�缫��ӦʽΪCH4-8e-+8OH-=CO2+6H2O
D. ͼ2�е��AlCl3��Һ���ܷ�ӦʽΪ: 2AlCl3+6H2O ![]() 2Al(OH)3��+3Cl2��+3H2��
2Al(OH)3��+3Cl2��+3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�У������¿�������������װ�˵���
A. Ũ���� B. Ũ���� C. ����ͭ��Һ D. ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֲ�ͬ�ѻ���ʽ�Ľ�������ľ�����ͼ��ʾ�������й�˵����ȷ���ǣ� ��
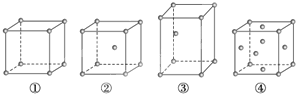
A. ��Ϊ�������ѻ�����Ϊþ�ͣ���Ϊ���ͣ���Ϊͭ��
B. ÿ���������е�ԭ�����ֱ�Ϊ����1������2������2������4��
C. ������ԭ�ӵ���λ���ֱ�Ϊ����6����8����8����12
D. �ռ������ʵĴ�С��ϵΪ���٣��ڣ��ۣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ��ͼ�ұ�ʾ���Ƕ����ڲ��ֻ�ȫ��Ԫ�ص�ij�����ʵĵݱ���ɣ�����˵����ȷ���ǣ� �� 
A.ͼ������Ϊԭ���������������ʾԪ�ص��������
B.ͼ������Ϊ�˵�������������ʾԪ�ص�ԭ�Ӱ뾶����λ��pm��
C.ͼ�Һ�����Ϊ������ۣ��������ʾԪ�ص�ԭ�Ӱ뾶����λ��pm��
D.ͼ�Һ�����Ϊ�������������������ʾԪ�ص�ԭ�Ӱ뾶����λ��pm��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com