
【题目】已知溶解度也可用物质的量浓度表示,25℃时,Ag2CrO4在不同浓度CrO42-溶液中的溶解度如图所示。又知Ksp(AgCl)=1.8×10-10。下列说法正确的是

A.图中a、b两点c(Ag+)相同
B.该温度下,Ag2CrO4溶度积的数量级为10-12
C.加热蒸发饱和Ag2CrO4溶液再恢复到25℃,可使溶液由a点变到b点
D.将0.01 mol/L AgNO3溶液滴入20mL0.01 mol/L KCl和0.01 mol/L K2CrO4的混合溶液中,CrO42-先沉淀
【答案】B
【解析】
A.曲线为达到沉淀溶解平衡时的曲线,a点和b点c(CrO42-)不一样,则c(Ag+)不相同,A错误;
B. 根据图象上相关数据,Ag2CrO4(s)![]() 2Ag+(aq)+CrO42-(aq),如以c(CrO42-)=10-2 mol/L时,溶解度为10-5 mol/L计算Ksp=c2(Ag+) c(CrO42-)=(2×10-5)2×10-2=4×10-12,则数量级为10-12,B正确;
2Ag+(aq)+CrO42-(aq),如以c(CrO42-)=10-2 mol/L时,溶解度为10-5 mol/L计算Ksp=c2(Ag+) c(CrO42-)=(2×10-5)2×10-2=4×10-12,则数量级为10-12,B正确;
C. 加热蒸发饱和Ag2CrO4溶液再恢复到25℃,仍然为该温度下的饱和溶液,各种微粒的浓度不变,因此不能使溶液由a点变到b点,C错误;
D. 由于Ksp(AgCl)=1.8×10-10,当溶液中KCl为0.01 mol/L时,形成沉淀需Ag+的浓度最小为c(Ag+)=![]() mol/L=1.8×10-8 mol/L,而Ksp(Ag2CrO4)=4×10-12,形成Ag2CrO4时需要Ag+的浓度最小为c(Ag+)=
mol/L=1.8×10-8 mol/L,而Ksp(Ag2CrO4)=4×10-12,形成Ag2CrO4时需要Ag+的浓度最小为c(Ag+)=![]() mol/L=2×10-5 mol/L,形成沉淀需要的Ag+浓度越小,先形成沉淀,可见等浓度的混合溶液中,Cl-先产生沉淀,D错误;
mol/L=2×10-5 mol/L,形成沉淀需要的Ag+浓度越小,先形成沉淀,可见等浓度的混合溶液中,Cl-先产生沉淀,D错误;
故合理选项是B。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最高的金属元素,其单质及其化合物在生产生活中的应用十分广泛。
(1)铝原子最外层电子排布式是________,铝原子核外有___种能量不同的电子。
(2)1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝。不用钾与氯化铝溶液制铝的理由是_________;现代工业炼铝是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为___________________________。
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:2Al+4BaO![]() 3Ba↑+BaO·Al2O3,用化学平衡移动原理解释上述方法可制取金属Ba的原因是________。
3Ba↑+BaO·Al2O3,用化学平衡移动原理解释上述方法可制取金属Ba的原因是________。
(4)LiAlH4由Li+、A1H4-构成,是有机合成中常用的试剂,LiAlH4在125℃分解为LiH、H2和Al。
①比较Li+、 H-、Al3+、H+离子半径大小____________。
②写出LiAlH4分解的方程式(需配平)_______,若反应生成3.36 L氢气(标准状况下),则有____g铝生成。
③LiAlH4与乙醛反应可生成乙醇,推断LiAlH4是反应的_________剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬是一种氧气吸收剂, 通常以二水盐[Cr(CH3COO)2]2 ·2H2O(式量:376)的形式存在,难溶于冷水,易溶于盐酸。其制备原理和实验装置:
制备原理:![]()
实验装置:(如图所示)

(1)仪器 A 的名称是__________。
(2)装好试剂后按上述装置进行实验,完成下表内容。
操作步骤 | 实验现象 | 发生反应的离子方程式 |
关闭①___________________,打开②_______________,(用K1、K2、K3填写,下同)使盐酸缓慢加入至抽滤瓶中 | 抽滤瓶中锌粒溶解,溶液由橙色逐渐变成蓝色,有少量气泡 | ③________,Zn+2H+=Zn2++H2↑ |
抽滤瓶中产生大量气体时快速加入适量盐酸,关闭K2和④__________________,打开⑤_________ | 抽滤瓶中⑥____________ | Zn+2H+=Zn2++H2↑ |
当溶液完全转移后,迅速塞紧锥形瓶,用冷水冷却 | 锥形瓶中有深红色晶体析出 | ⑦_____________ |
(3)洗涤产品后干燥、称量,得到 1.0g 固体。列式表示产率:____(不必计算出结果,K2Cr2O7 式量:294)。在实验中如果盐酸过量,会导致产率偏________。(填“高”或“低”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①25℃时,NaHCO3溶液呈碱性,原因是___________水解引起的(填“Na+”或“HCO3-”);
②常温下,0.0100mol/L 盐酸的pH=___________;
③用0.0100mol/L 盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为___________(填“蓝色”或“无色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1mol H2O(g)时放出241.8kJ 的热量,请完成该反应的热化学方程式:2H2(g) +O2(g)=2H2O(g) △H=___________kJ/mol;
②已知:C(石墨,s)=C(金刚石,s) △H>0,则稳定性: 石墨___________金刚石 (填“>”、“<”或“=”)。
(3)在某密闭容器中进行可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0,平衡常数表达式为K=
Fe(s)+CO2(g) △H>0,平衡常数表达式为K=![]() 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________方向移动(填“正反应”或“逆反应”);
②若升高温度,平衡常数K___________(填“增大”、“减少”或“不变”);
③查阅资料得知1100℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________平衡状态(填“达到”或“未达到”)。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
①根据氧化还原反应:2Ag+(aq)+Cu(s)=2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液时__________溶液(填“CuSO4”或“AgNO3”);
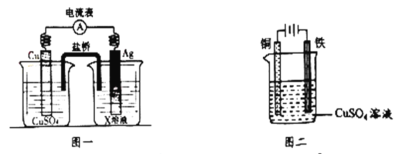
②图二装置在铁件上镀铜,铁作阴极,则铜极上的电极反应是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型漂白剂结构如图所示,其中W.Y.Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列说法正确的是
![]()
A.非金属性:X>W>Y
B.Y的最高价氧化为对应的水化物为三元酸
C.可利用W与X、Y形成的化合物热还原制备单质Y
D.该漂白剂中仅有X均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
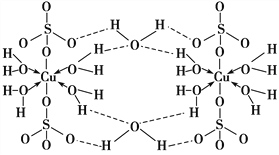
下列有关胆矾的说法正确的是( )
A. 所有氧原子都采取sp3杂化 B. 氧原子参与形成配位键和氢键两种化学键
C. Cu2+的价电子排布式为3d84s1 D. 胆矾中的水在不同温度下会分步失去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。
(1)按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于_________区。
(2)Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+ ,请从离子的价电子式角度解释Mn2+与Fe2+还原能力的差别:_________。Mn2+的半径_________ Fe3+的半径(填“>”、“<”或“=”)。
(3)金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为_________(用含π的式子表示)。
(4)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。N、H、O三种元素的电负性由大到小的顺序为_________;[Fe(SCN)(H2O)5]2+中Fe3+的配位数为_________,H2O中氧原子的杂化方式为_________。
(5)二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2,可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H![]() )配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π
)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H![]() 的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
A 离子键 B 配位键 C σ 键 D 范德华力

(6)一种含有Fe、Cu、S三种元素的矿物的晶胞(如上图b所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________。若晶胞的底面边长为A pm,高为C pm,阿伏伽德罗常数为NA,则该晶体的密度为__________ g/cm3(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、N及S的化合物用途非常广泛。回答下列问题;
(1)基态Fe原子价电子排布图为____;基态S原子的核外电子占据最高能级的电子云轮廓图为__________形。
(2)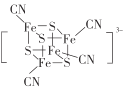 团簇离子中,Fe2+、Fe3+数目之比为______;与铁形成配位键的原子是________,铁的配位数为_________。
团簇离子中,Fe2+、Fe3+数目之比为______;与铁形成配位键的原子是________,铁的配位数为_________。
(3)四氟铵可通过下列反应制备:NF3+F2 + BF3 =NF4 BF4
①NF3的空间构型为_____ , 中心原子的杂化方式是______。
②NF4BF4存在的作用力有________(填字母)。
A. σ键 B. π键 C.离子键. D.配位键
(4)Fe与S形成的一种化合物晶体的结构如图所示,六棱柱底边边长为a pm,高为c pm,阿伏加德罗常数的值为NA,该Fe、S化合物晶体的密度为_____(列出计算式)g. cm-3
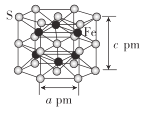
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究用AgNO3溶液将混合溶液中的Cl-和CrO42-沉淀分离,绘制了25℃时AgCl和Ag2CrO4两种难溶化合物的溶解平衡曲线。其中,pAg+= -lgc(Ag+),其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法错误的是( )

A.Ksp(Ag2CrO4)约为1 ×10-12,Ksp(AgCl)的数量级为10-10
B.M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Cl-、CrO42-均为0.1 mol/ L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
D.向Ag2CrO4、AgCl混合固体和水的溶解平衡体系中加入少量水, 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com