
1mol D2O和1mol H2O不相同的是( )
|
| A. | 含有中子的数目 | B. | 含有电子的数目 |
|
| C. | 含有质子的数目 | D. | 含氧原子的数目 |
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
|
| A. | 在离子化合物中不可能存在非极性键 |
|
| B. | 气体单质分子中一定存在非极性键 |
|
| C. | 在共价化合物中不可能存在离子键 |
|
| D. | 由非金属元素组成的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有以下物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④汞 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) 熔化K2SO4⑨纯水.请回答下列问题(用序号):
(1)以上物质中能导电的是
(2)以上物质属于电解质的
(3)以上物质中属于非电解质的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
迷迭香酸具有抗氧化、延缓衰老、减肥降脂等功效,它的结构简式为:

以邻苯二酚为原料合成迷迭香酸的路线为:

下列说法正确的是( )
|
| A. | 有机物A分子中所有原子一定在同一平面上 |
|
| B. | 有机物B可以发生取代、加成、消去、氧化反应 |
|
| C. | 有机物C在稀硫酸催化下水解的一种产物是B |
|
| D. | 1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
3,4,5﹣三甲氧基苯甲醛是制备抗菌增效剂TMP的中间体,通常可以由以下途径加以合成.
途径1:分别以苯酚和对硝基甲苯为起始原料,通过一系列反应合成3,4,5﹣三甲氧基苯甲醛,其合成路线如下:
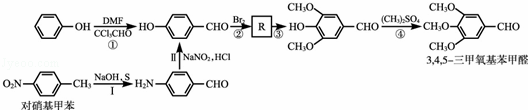
(1)用对硝基甲苯制备的第Ⅰ步所涉及的反应类型有 (用相应的编号表示).
A.氧化反应 B.加成反应 C.还原反应 D.消去反应 E.取代反应
(2)第②步中与Br2反应后的产物R的结构简式为 .
途径2:从造纸废液中提取的香兰醛作为原料来合成3,4,5﹣三甲氧基苯甲醛,其反应过程如下:

(3)写出第⑥步的化学反应方程式 .
(4)写出2种满足下列条件的香兰醛的同分异构体: .
①不能与FeCl3溶液发生显色反应;
②核磁共振氢谱显示,该物质中存在四种不同环境的氢原子,其个数之比为3:2:2:1.
途径3:没食子酸只含C、H、O三种元素,是一种重要的有机酸,其应用广泛,以它为原料可以合成3,4,5﹣三甲氧基苯甲醛.
(5) 是没食子酸的球棍模型,请结合有机结构特征,写出没食子酸的结构简式 .
是没食子酸的球棍模型,请结合有机结构特征,写出没食子酸的结构简式 .
(6)已知:R1﹣COOR2 R1﹣CONH﹣NH2
R1﹣CONH﹣NH2 R1﹣CHO
R1﹣CHO
请你结合途径1和途径2中合成线路的表示方式,设计用没食子酸合成3,4,5﹣三甲氧基苯甲醛的合成路线.
查看答案和解析>>
科目:高中化学 来源: 题型:
镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有( )
|
| A. | [Al (OH)4]﹣ | B. | Cu2+ | C. | Al3+ | D. | Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
分布在三个不同短周期的四种元素A、B、C、D的原子序数依次增大,其中B、C同周期,A、D同主族.常温下,BA3溶液的显碱性;C是地壳中含量最高的元素;D是所在周期原子半径最大的元素.下列说法正确的是( )
|
| A. | 原子半径:D>C>B>A |
|
| B. | 气态氢化物的热稳定性:HmB>HnC |
|
| C. | 由A、B、C三种元素形成的化合物均只含有共价键,不含离子键 |
|
| D. | 单质D与水反应放出氢气,当转移2NA个电子时,产生氢气的体积为22. 4升(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:
不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金。
Ⅰ.氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。

(1)此配合物中,铁离子的价电子排布式为 。
(2)此配合物的-C2H5中C-H间形成化学键的原子轨道分别是 ; 。
Ⅱ.(2)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n ,与Ni(CO)n中配体互为等电子体的离子的化学式为 (写出一个即可)。
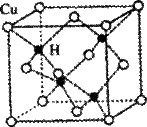
(2)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。已知CuH晶体结构单元如图所示。该化合物的的密度为ρg/cm3,阿伏加德罗常数的值为NA,则该晶胞中Cu原子与H原子之间的最短距离为 cm(用含ρ和NA的式子表示)。
Ⅲ.硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域应用。
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为 ,B原子的杂化类型为 。
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。下图示意的是磷化硼的晶体结构单元,则磷化硼的化学式为 ,微粒间存在的作用力为 。

(3)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连(如下图)。

①1 mol H3BO3的晶体中有 mol氢键。
②硼酸溶于水应生成弱电解质一水合硼酸H2O·B(OH)3,它电离生成少量[B(OH)4]- 和的H+ 离子。则硼酸为 元酸,[B(OH)4]-含有的化学键类型为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的颜色变化,可用勒夏特列原理解释的是( )
|
| A. | 光照氯水,颜色变浅 |
|
| B. | 向盛有NO2的集气瓶中投入活性炭,颜色变浅 |
|
| C. | 加热氯化铁溶液,溶液变浑 |
|
| D. | 压缩H2与I2(g)反应的平衡混合气体,颜色变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com