
【题目】探究铁在某浓度H3PO4和H2O2的混合溶液中反应的情况,进行如下实验:
实验 | 操作 | 现象 |
Ⅰ | 将除去氧化膜的铁钉置于烧杯中,加入30mL1.0molL-1H3PO4和3mL30%H2O2的混合溶液(pH≈1)。 | 一段时间后铁钉表面突然产生大量气泡,随后停止产生气泡;一段时间后再产生大量气泡,再停止,出现周而往复的现象。过程中,溶液保持澄清。
|
Ⅱ | 将与实验Ⅰ相同的铁钉放入烧杯中,加入30mL1.0molL-1H3PO4和3mLH2O。 | 片刻后铁钉表面持续产生气泡,溶液保持澄清。 |
已知:Fe3(PO4)2难溶于水,Fe(H2PO4)2溶于水。
(1)用85%H3PO4配制100mL1.0mol·L-1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、______。
(2)请结合实验Ⅱ中现象,分析铁钉与H3PO4反应的产物_______。
(3)探究实验Ⅰ中停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀H2SO4,振荡,静置,溶液呈红色。
乙同学认为实验Ⅲ无法证实假设成立,其理由是未排除O2的干扰,请解释O2是如何干扰实验的:_____。
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在铁钉表面的H2脱离铁钉表面。形成氧化膜(以Fe3O4计)的离子方程式是____。
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率角度分析其原因:______。
【答案】100mL容量瓶 Fe+2H3PO4=Fe(H2PO4)2+H2↑ 氧气在酸性条件下可以将亚铁离子氧化成铁离子,发生反应4Fe2++O2+4H+=4Fe3++2H2O 3Fe2++H2O2+2H2O=Fe3O4+6H+ 铁与磷酸反应生成氢气和Fe2+,Fe2+在铁钉表面迅速被氧化形成氧化膜,使聚集在铁钉表面的氢气脱离;随后发生磷酸溶解氧化膜的慢反应,氧化膜覆盖铁钉表面时不产生气泡,当氧化膜溶解后,铁又与磷酸反应产生氢气
【解析】
题目是进行探究性实验,在实验Ⅰ中,铁钉表面产生气泡,是因为铁与H3PO4反应生成氢气,因为溶液保持澄清,根据信息可知还生成了溶于水的Fe(H2PO4)2,一段时间后再产生大量气泡,再停止,出现周而往复的现象,与实验Ⅱ对比可知是H2O2发生了作用,结合题目信息可知双氧水可将亚铁离子氧化成铁离子形成氧化膜,使聚集在铁钉表面的氢气脱离;随后发生磷酸溶解氧化膜的慢反应,氧化膜覆盖铁钉表面时不产生气泡,当氧化膜溶解后,铁又与磷酸反应产生氢气。
(1)配制100mL1.0mol·L-1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、100mL容量瓶;
(2)在实验Ⅰ中,铁钉表面产生气泡,是因为铁与H3PO4反应生成氢气,因为溶液保持澄清,根据信息可知还生成了Fe(H2PO4)2,化学方程式为Fe+2H3PO4=Fe(H2PO4)2+H2↑;
(3)氧气在酸性条件下可以将亚铁离子氧化成铁离子,发生反应4Fe2++O2+4H+=4Fe3++2H2O,故实验Ⅲ无法证实假设成立;
(4)亚铁离子被H2O2溶液形成氧化为Fe3O4,根据电子守恒和元素守恒可得离子方程式为:3Fe2++H2O2+2H2O=Fe3O4+6H+;
(5)根据分析可知原因为:铁与磷酸反应生成氢气和Fe2+,Fe2+在铁钉表面迅速被氧化形成氧化膜,使聚集在铁钉表面的氢气脱离;随后发生磷酸溶解氧化膜的慢反应,氧化膜覆盖铁钉表面时不产生气泡,当氧化膜溶解后,铁又与磷酸反应产生氢气,


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极,下列叙述错误的是( )
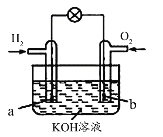
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH――4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.溶液中OH-向正极移动,K+、H+向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
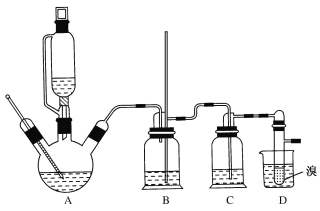
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是___。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是____。
(3)在装置C中应加入NaOH溶液,其目的是____。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法是___。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层(填“上”或“下”)。若产物中有少量未反应的Br2,最好用___洗涤除去;若产物中有少量副产物乙醚,可用____(填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是___。
(7)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常监测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molBaCl2晶体中所含离子总数为0.2NA
B.25℃时,pH=1的HC1溶液中含有H+的数目为0.1NA
C.17gH2O2中含有非极性键数目为0.5NA
D.生成2.33gBaSO4沉淀时,转移电子数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钪(Sc2O3)在合金、电光源、催化剂、激活剂和陶瓷等领域有广泛的应用,利用钪精矿为原料(主要成分为Sc2O3,还含有Fe2O3、MnO等杂质)生产氧化钪的一种工艺流程如下:

(1)“酸溶”步骤中,钪的浸出率结果如图所示。由图可知,为使钪的浸出率达90%左右,所采用的生产条件为___________________。

(2)加入氨水调节pH=3,过滤,滤渣主要成分是_____________;若再向滤液加入氨水调节pH=6,滤液中 Sc3+能否沉淀完全(离子浓度小于105 mol/L)?______________(列式计算并作判断)。(25℃时,Ksp[Mn(OH)2]=1.9×1013、Ksp[Fe(OH)3]=2.6×1039,Ksp[Sc(OH)3]=9.0×1031)
(3)已知钪与铝类似,其氢氧化物具有两性。反萃取步骤中,加入NaOH使溶液呈碱性,碱性条件下双氧水可以氧化锰离子生成滤渣,写出该反应的离子方程式______________。
(4)“沉钪”前先加入稀盐酸调节溶液至酸性,然后用草酸“沉钪”。25℃时pH=2的草酸溶液中![]() =_________________________。写出“沉钪”得到草酸钪(难溶于稀酸)的离子方程式___________________[25℃时,草酸电离平衡常数为Ka1=5.0×102,Ka2=5.4×105]。
=_________________________。写出“沉钪”得到草酸钪(难溶于稀酸)的离子方程式___________________[25℃时,草酸电离平衡常数为Ka1=5.0×102,Ka2=5.4×105]。
(5)草酸钪“灼烧”的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,有下列五种溶液:
①0.1mol/LNH4Cl②0.1mol/LCH3COONH4③0.1mol/LNH4HSO4
④0.1mol/LNH4HCO3 ⑤0.1mol/LNaHCO3
请根据要求填写下列空白:
(1)溶液①呈 ______ 性(填“酸”、“碱”或“中”),其原因是: ______ (用离子方程式表示)
(2)溶液⑤呈 ______ 性(填“酸”、“碱”或“中”),其原因是: ______ (用离子方程式表示)
(3)比较溶液①、③中c(NH4+)的大小关系是① ______ ③(填“>”、“<”或“=”)
(4)常温下,测得溶液②的pH=7,则CH3COO-的水解程度 ______ NH4+的水解程度(填“>”、“<”或“=”),CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____c(NH4+)(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在指定的环境中一定能大量共存的是( )
A.某无色酸性溶液中:NH![]() 、Ca2+、F-、Cl-
、Ca2+、F-、Cl-
B.与金属铝反应只放出氢气的溶液:K+、NH![]() 、NO
、NO![]() 、Cl-
、Cl-
C.能使淀粉碘化钾试纸变蓝的溶液中:Na+、NH![]() 、S2-、Br-
、S2-、Br-
D.滴加酚酞试液变红色的溶液:K+、Na+、S2-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用如图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如下表:


(1)写出Na2O2和H2O反应的化学方程式_______。
(2)计算过氧化钠质量分数时,除了试样的质量,锥形瓶和水的质量,还必需的数据是______,不必作第6次读数的原因是______。
(3)根据上述数据,过氧化钠的质量分数是_____(保留2位小数)。
(4)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如图:
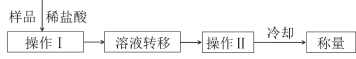
①操作Ⅰ的名称是_____。
②需直接测定的物理量是_____。
③操作Ⅱ需要的仪器除了酒精灯,还需要_____(固定、夹持仪器除外)。
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果_____(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.电解CuCl2溶液:CuCl2=Cu2++2Cl-
B.Mg和Cl形成离子键的过程:![]()
C.向Al2(SO4)3溶液中滴加Na2CO3溶液:2Al3++3CO32-=Al2(CO3)3↓
D.乙酸与乙醇发生酯化反应:CH3COOH+C2H518OH![]() CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com