
【题目】五倍子是一种常见的中草药,其有效成分为X。一定条件下X可分别转化为Y、Z,如下所示。
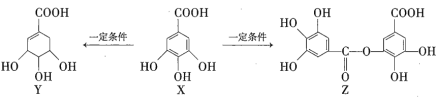
下列说法错误的是( )
A.![]() 最多能与
最多能与![]() 发生取代反应
发生取代反应
B.等物质的量的Z分别与Na和![]() 恰好反应时,消耗Na和
恰好反应时,消耗Na和![]() 的物质的量之比为6∶1
的物质的量之比为6∶1
C.一定条件下,Y能发生加成反应、取代反应、消去反应和氧化反应
D.![]() 最多能与
最多能与![]() 发生反应
发生反应
【答案】D
【解析】
A.1molX中的含有2mol酚羟基的邻位氢原子,可以与Br2发生取代反应,所以1molX最多能与2molBr2发生取代反应,故A正确;
B.Z中含有酚羟基和羧基,其中酚羟基和羧基都能与金属钠反应放出氢气,只有羧基能够与碳酸氢钠反应放出二氧化碳,因此等物质的量的Z分别与Na和![]() 恰好反应时,消耗Na和
恰好反应时,消耗Na和![]() 的物质的量之比为6∶1,故B正确;
的物质的量之比为6∶1,故B正确;
C.Y中含有的碳碳双键,能发生加成反应,醇羟基和羧基能发生取代和聚合反应,醇羟基的邻位碳原子上有氢原子可以发生消去反应,其中的羟基能被氧化为酮,故C正确;
D.在1molZ中含有1mol水解后的产物中含有2mol羧基和6mol酚羟基,最多可以和8molNaOH发生反应,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放。
(1)用化学方程式表示NO形成硝酸型酸雨的反应______
(2)能作脱除剂的物质很多,下列说法正确的是______
a.用H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
(3)尿素[CO(NH2)2]在一定条件下能有效将NOx转化为N2
Ⅰ.已知可通过下列方法合成尿素:2NH3(g)+CO2(g)![]() H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(l) △H=+28.5kJ/mol
CO(NH2)2(s)+H2O(l) △H=+28.5kJ/mol
①尿素释放出NH3的热化学方程式是______。
②写出有利于尿素释放NH3的条件并说明理由______。
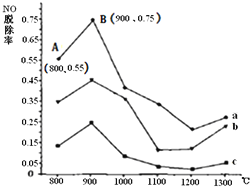
ⅡCO(NH2)2与某种烟气![]() 主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
①曲线a对应CO(NH2)2与NO的物质的量比值是______。
②曲线a、b、c中,800℃~900℃区间内发生主要反应的化学方程式是______。
③900℃~1200℃区间内脱除率下降,NO浓度上升,发生的主要反应是______。
④曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为______mg/(m3·s) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学原理的相关知识填空。
⑴常温时,![]() 的水溶液呈酸性,原因是
的水溶液呈酸性,原因是![]() 用离子方程式表示
用离子方程式表示![]() :___________,将
:___________,将![]() 溶液蒸干,灼烧,最后得到的固体产物主要是__________
溶液蒸干,灼烧,最后得到的固体产物主要是__________![]() 填化学式
填化学式![]() 。
。
⑵向![]() 溶液滴加石蕊溶液后变红,则
溶液滴加石蕊溶液后变红,则![]() 的电离程度______其水解程度
的电离程度______其水解程度![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]() 。该物质能_______
。该物质能_______![]() 填“促进”或“抑制”
填“促进”或“抑制”![]() 水的电离。
水的电离。
⑶若想除去![]() 溶液中混有
溶液中混有![]() 杂质,则往往加入试剂 ________。
杂质,则往往加入试剂 ________。
![]()
![]()
![]()
![]()
⑷泡沫灭火器的灭火原理为___________![]() 用离子方程式解释
用离子方程式解释![]()
⑸在苏打溶液中存在的电荷守恒式为__________;质子守恒式为__________
⑹常温下,物质的量浓度相同的下列溶液:![]()
![]()
![]()
![]()
![]() 溶液中
溶液中![]() 从大到小排列顺序为________
从大到小排列顺序为________![]() 填序号
填序号![]() 。
。
⑺现有a.醋酸、b.盐酸、c.硫酸三种溶液,根据要求答题。
![]() 若它们物质的量浓度相等,它们的pH由大到小的关系为_______(用abc表示,下同)。
若它们物质的量浓度相等,它们的pH由大到小的关系为_______(用abc表示,下同)。
![]() 若它们的pH相等,它们物质的量浓度由大到小的关系为_____。
若它们的pH相等,它们物质的量浓度由大到小的关系为_____。
![]() 若它们的pH相等,均加水稀释100倍后,其pH由大到小的关系为________。
若它们的pH相等,均加水稀释100倍后,其pH由大到小的关系为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们认识最早的盐是食盐,![]() 尚书
尚书![]() 说命
说命![]() 记载:“若作和羹,尔惟盐梅”,说明劳动人民在商代就已经知道用盐配制美味的羹汤。而现代化学定义的盐,具有更广范围和更深的涵义,探索它们的奥秘可以使我们更科学的利用它们。今对
记载:“若作和羹,尔惟盐梅”,说明劳动人民在商代就已经知道用盐配制美味的羹汤。而现代化学定义的盐,具有更广范围和更深的涵义,探索它们的奥秘可以使我们更科学的利用它们。今对![]() 、
、![]() 、
、![]() 、
、![]() 四种常见的盐进行探究。回答下列问题:
四种常见的盐进行探究。回答下列问题:
⑴已知![]() 时,AgCl的溶度积为
时,AgCl的溶度积为![]() ,则AgCl在
,则AgCl在![]() 溶液中的
溶液中的![]() 为________
为________![]() 。
。
⑵![]() 时,
时,![]() 溶液的
溶液的![]() ,则关于该溶液中
,则关于该溶液中![]() 的说法正确的是________。
的说法正确的是________。
A.与m无关的定值 ![]() 与m有关的定值
与m有关的定值 ![]() 与
与![]() 有关的不定值
有关的不定值
⑶![]() 时,将
时,将![]() 溶液和
溶液和![]() 溶液各
溶液各![]() 混合,此时混合溶液的
混合,此时混合溶液的![]() ,则
,则![]() 的电离平衡常数
的电离平衡常数![]() ________
________![]() 用含n的表达式表示
用含n的表达式表示![]() 。
。
⑷将![]() 、生石灰和水按一定比例混合可得杀菌剂波尔多液,其有效成分为难溶的碱式硫酸铜
、生石灰和水按一定比例混合可得杀菌剂波尔多液,其有效成分为难溶的碱式硫酸铜![]() ,为测定其中x与y的比值,进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸为
,为测定其中x与y的比值,进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸为![]() ,另一份高温灼烧后只得到
,另一份高温灼烧后只得到![]() 固体。所得数据显示
固体。所得数据显示![]() ,则该碱式硫酸铜的化学式中
,则该碱式硫酸铜的化学式中![]() ________。
________。
⑸![]() 时,向
时,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的盐酸
的盐酸![]() ,溶液的pH逐渐降低,此时溶液中含硫元素的微粒物质的量浓度的百分含量
,溶液的pH逐渐降低,此时溶液中含硫元素的微粒物质的量浓度的百分含量![]() 纵轴
纵轴![]() 也发生变化,如图所示:
也发生变化,如图所示:
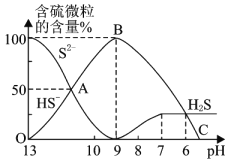
![]() 反应到A点时,溶液中的离子浓度大小的关系为________。
反应到A点时,溶液中的离子浓度大小的关系为________。
![]() 点对应的溶液中大量存在的溶质是________。
点对应的溶液中大量存在的溶质是________。
![]() 混合溶液的
混合溶液的![]() ________时,溶液中开始有
________时,溶液中开始有![]() 气体放出。
气体放出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L和密闭容器中放入4mol N2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g),反应进行到5min时,测得N2O5转化了20%,求:
4NO2(g)+O2(g),反应进行到5min时,测得N2O5转化了20%,求:
(1)5min时,剩余N2O5的物质的量________;
(2)前5min,v(NO2)为多少__________;
(3)5min时,O2的物质的量占混合气体总物质的量的百分比_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物醇A与羧酸B发生酯化反应生成分子式为C9H18O2的酯,0.5molA完全燃烧产生的气体被足量的澄清石灰水吸收生成200g沉淀,则下列说法正确的是( )
A.A的分子式为C4H8OB.B的分子式为C5H10O2
C.酯C9H18O2在稀硫酸溶液中不水解D.有机物A、B都能与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎纸条的作用是________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”、“偏小”或“无影响”)。
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1 NaOH溶液各50 mL进行实验,其中NaOH溶液浓度大于盐酸浓度的作用是______,当室温低于10 ℃时进行实验,对实验结果会造成较大的误差,其原因是_____________。
(5)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求得的中和热________(填“相等”或“不相等”),简述理由: ______________。
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热ΔH将________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用下图所列装置(固定装置略)验证CO能还原CuO,并探究其还原产物的组成。
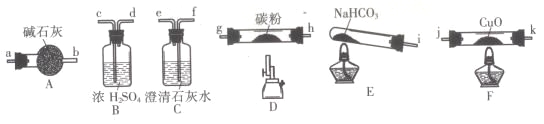
请回答:
(1)按气流方向,各装置从左到右的连接顺序为:
i→______________________________________尾气处理(填仪器接口的字母编号)。
(2)说明CO能还原CuO的实验现象为___________________________。
(3)该实验处理尾气的方法为___________________________。
(4)若去掉B装置,可能产生的影响为___________________________。
(5)将各装置按正确的顺序连接后进行实验。当反应结束后,F处硬质玻璃管中的固体全部变为红色。
[查阅资料]Cu和Cu2O均为红色;Cu2O在酸性溶液中能生成Cu和Cu2+。
[提出猜想]红色固体的成分可能为:①Cu;②Cu2O;③________。
[实验验证]该小组为验证上述猜想,分别取少量红色固体放入试管中,进行如下实验。
实验编号 | 操作 | 现象 |
a | 加入足量稀硝酸,振荡 | 试管内红色固体完全溶解,溶液变为蓝色,并有无色气体产生 |
b | 加入足量稀硫酸,振荡 | 试管内有红色固体,溶液为无色 |
[实验评价]根据上述实验,不能确定红色固体成分的实验是________(填实验编号),理由为_________(用化学方程式表示)。
[实验结论]根据上述实验结果,可知红色固体的成分为________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com