
A、B、C、D四种物质均易溶于水(均不与水反应),分别按下列条件配成溶液,其中物质的量浓度最大的是 ( )
A.10 mL 5mol·L-1的A溶液加水配制成100 mL溶液
B.9.2 g B物质(相对分子质量为46)溶于水配成100 mL溶液
C.1.806×1023个C的分子溶于水配成100 mL溶液
D.0.1 moL D物质溶于100 mL 2.5 mol·L-1的D溶液中
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源:2016-2017学年福建省龙岩四校高一上学期期中联考化学试卷(解析版) 题型:选择题
下列变化不属于化学科学研究的范畴的是( )
A.电解水生成氢气和氧气 B.合成有机高分子材料
C.原子弹发生剧烈爆炸 D.牛产合成纤维和合成橡胶
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一上期中化学试卷(解析版) 题型:选择题
现有A、B、C三种化合物, 各取40 g相混合, 完全反应后,得18 g B、49 g C,还有D生成.已知D的相对分子质量为106.现将80 g A和33g B反应, 能生成D ( )
A、1 mol B、0.5 mol C、0.75 mol D、0.25 mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一上期中化学试卷(解析版) 题型:实验题
①某NaCl样品中可能含有SO42-、CO32-,为检验杂质离子的存在,采取如下实验步骤:
样品 无明显现象
无明显现象 无明显现象。
无明显现象。
则加入的试剂A为 ,B为 (填化学式),该现象证明样品中不含有 。
②在后续实验中需要使用450mL0.5 mol·L-1NaCl溶液,为配制该浓度NaCl溶液进行实验,需用托盘天平称取NaCl g。
③配制NaCl溶液时,若出现下列操作,会使配制浓度偏高的是( )
A.称量时NaCl已潮解 |
B.天平砝码已锈蚀 |
C.定容时俯视刻度线 |
D.定容摇匀后液面下降,又加水至刻度 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一上期中化学试卷(解析版) 题型:选择题
甲、乙 、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、C
、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、C l-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生
l-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生 成;② 0.1 mol·L-1乙溶液中c(H+)>0.1 mol·L-1;③ 向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是( )
成;② 0.1 mol·L-1乙溶液中c(H+)>0.1 mol·L-1;③ 向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是( )
A. 甲溶液含有OH- B.乙溶液含有SO42-
C. 丙溶液含有Cl- D.丁溶液含有Mg2+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省郏县一高、叶县二高等五校高二上期中化学卷(解析版) 题型:选择题
对于可逆反应:2A(g)+B(g) 2c(g)△H<0,下列各图正确的是 ( )
2c(g)△H<0,下列各图正确的是 ( )
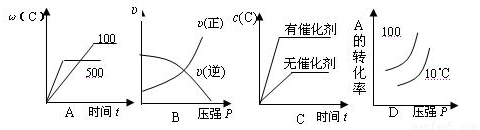
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省襄阳市四校高一上学期期中化学试卷(解析版) 题型:推断题
A、B、C、D四种可溶性盐,它们的阳离子可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子可能是NO3-、SO42-、Cl-、CO32-的某一种(每种离子只能使用一次);
①若把四种盐分别溶解于盛有蒸馏水的四只试管中,只有C盐的溶液呈蓝色;
②若向四只试管中分别加足量盐酸,B溶液有沉淀产生,D溶液有无色无味气体 逸出。
逸出。
根据①②实验事实可推断它们的化学式为:
(1)A、 ;B、 ;C、 ;D、 ;
(2)写出②中D与盐酸反应的离子方程式: 。
(3)某溶液中含有少量的CaCl2,某学生用过量的D使Ca2+离子转化为沉淀而除去,确认D已过量的实验操作是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上学期期中化学试卷(解析版) 题型:填空题
(1)甲醇蒸气转化为氢气的一种原理是CH3OH和H2O反应生成CO2和H2。
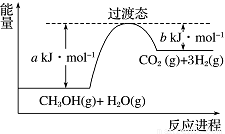
下图是该过程中能量变化示意图。若在反应体系中加入催化剂,反应速率增大,正反应活化能a的变化是___________(填“增大”、“减小”或“不变”),反应热ΔH的变化是________(填“增大”、“减小”或“不变”)。请写出反应进程CH3OH(g)和H2O(g)反应的热化学方程式___________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2C O2(g) ΔH=-bkJ·mol-1(b>0)
O2(g) ΔH=-bkJ·mol-1(b>0)
若用标准状况下4.48 L CO还原NO2至N2(CO完全反应),整个过程中转移电子的物质的量为________,放出的热量为________kJ(用含有a和b的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com