
【题目】根据已学知识,回答下列问题。
(1)已知下列元素基态原子的电子排布式,判断它们所在的周期和族。
①![]() ___________________ ;
___________________ ;
②![]() ___________________ ;
___________________ ;
③![]() ___________________ ;
___________________ ;
④![]() ___________________ 。
___________________ 。
(2)已知下列元素在周期表中的位置,写出它们的元素符号和价电子排布式。
①第4周期IVB族____________、____________;
②第5周期VIIA族____________、____________。
【答案】第3周期ⅢA族 第4周期ⅥB族 第4周期Ⅷ族 第6周期ⅣA族 Ti 3d24s2 I 5s25p5
【解析】
(1)由电子排布式中的能层序数判断所在的周期,由外围电子数判断所在的族;
(2)结合前36号元素和主族元素的元素符号和价电子排布解答。
(1)①电子排布式为![]() 的为铝元素,位于第3周期ⅢA族,故答案为:第3周期ⅢA族;
的为铝元素,位于第3周期ⅢA族,故答案为:第3周期ⅢA族;
②电子排布式为![]() 的为Cr元素,位于第4周期ⅥB族,故答案为:第4周期ⅥB族;
的为Cr元素,位于第4周期ⅥB族,故答案为:第4周期ⅥB族;
③电子排布式为![]() 的为Fe元素,位于第4周期Ⅷ族,故答案为:第4周期Ⅷ族;
的为Fe元素,位于第4周期Ⅷ族,故答案为:第4周期Ⅷ族;
④电子排布式为![]() ,最高能层为第6层,最外层为4个电子,位置为:第6周期ⅣA族,故答案为:第6周期ⅣA族;
,最高能层为第6层,最外层为4个电子,位置为:第6周期ⅣA族,故答案为:第6周期ⅣA族;
(2)①第4周期IVB族的元素为Ti,价电子排布式为:3d24s2,故答案为:Ti;3d24s2;
②第5周期VIIA族为I,价电子排布式为5s25p5,故答案为:I;5s25p5。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】用符号“>”或“<”表示下列各项关系。
(1)第一电离能:Na __________ Mg,Mg _______ Ca。
(2)电负性:O ________ F,F ________ Cl。
(3)能量高低:ns ________ (n+1)s,ns ________ np。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.4.0g由CO2和SO2组成的混合物中含有的质子数为2NA
B.1L0.5mol/LpH=7的CH3COONH4溶液中NH4+数目为0.5NA
C.常温下,0.1mol环氧乙烷(![]() )中含有的共价键数目为0.3NA
)中含有的共价键数目为0.3NA
D.22.4LCO2与足量Na2O2充分反应,转移的电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的原子最外层电子排布式是![]() ,该元素或其单质不可能具有的性质是( )
,该元素或其单质不可能具有的性质是( )
A.该元素的金属性比铝元素的强
B.该元素的单质在一定条件下能与盐酸反应
C.该元素位于第五周期ⅢA族
D.该元素的最高化合价为+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交联聚合物P的结构片段如图所示。下列说法不正确的是(图中![]() 表示链延长)
表示链延长)

A. 聚合物P中有酯基,能水解
B. 聚合物P的合成反应为缩聚反应
C. 聚合物P的原料之一丙三醇可由油脂水解获得
D. 邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钾是一种剧毒物质,贮存和使用时必须注意安全。已知:![]() 。回答下列问题:
。回答下列问题:
(1)![]() 中所含三种元素的第一电离能从大到小的顺序为____________________(用元素符号表示,下同),电负性从大到小的顺序为__________,基态氮原子最外层电子排布式为__________。
中所含三种元素的第一电离能从大到小的顺序为____________________(用元素符号表示,下同),电负性从大到小的顺序为__________,基态氮原子最外层电子排布式为__________。
(2)与![]() 互为等电子体的分子为__________(任举一例)。
互为等电子体的分子为__________(任举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式错误的是( )
A.用惰性电极电解氯化铝溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B.NaHSO3溶液在空气中变质:2HSO3-+O2=2SO42-+2H+
C.酸性K2Cr2O7溶液氧化双氧水:Cr2O72-+8H++3H2O2=2Cr3++3O2↑+7H2O
D.向Ag(NH3)2OH溶液中加入盐酸:Ag++Cl-=AgCl↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属原子在二维平面里放置有如图所示的两种方式,下列说法正确的是( )
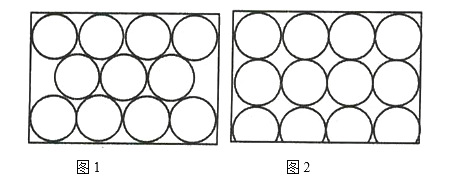
A.图1为非密置层,配位数为6
B.图2为密置层,配位数为4
C.图1在三维空间里堆积可得A3型和A1型两种堆积模型
D.图2在三维空间里堆积可得A3型堆积模型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰是制取其他含锰化合物的原料,也可用作脱硫的催化剂等。一种焙烧氯化铵和菱锰矿粉制备高纯度碳酸锰的工艺流程如图所示
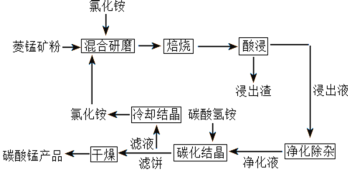
已知①菱锰矿粉的主要成分是MnCO3,还有少量的Fe、Al、Ca、Mg等元素
②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
③常温下,Ksp(CaF2)=1.46×1010,Ksp(MgF2)=7.42×1011;Ka(HF)=1.00×104
回答下列问题:
(1)“混合研磨”的作用为_______________________
(2)“焙烧”时发生的主要反应的化学方程式为_________________________________
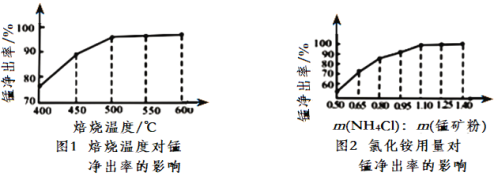
(3)分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是_____________________________
(4)净化除杂流程如下
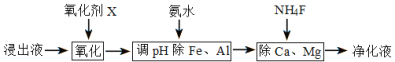
①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+,则氧化剂X宜选择__________
A. (NH4)2S2O8 B. MnO2 C. KMnO4
②调节pH时,pH可取的范围为_________________
③常温下加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液中,![]() =______若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
=______若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
(5)“碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com