
|
恒温下的下列实验过程中,有关溶液的浓度和质量始终不变的是 | |
| [ ] | |
A. |
向浓氨水中持续通入干燥洁净的空气(不含CO2) |
B. |
向KNO3饱和溶液中加入ngKNO3晶体 |
C. |
向98.3%浓H2SO4中加入ngSO3 |
D. |
向CuSO4饱和溶液中加入ng无水CuSO4 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol?L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
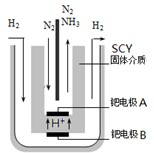 此条件下,该反应达到化学平衡时,氮气的浓度为
此条件下,该反应达到化学平衡时,氮气的浓度为
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

 2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是
2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com