
【题目】0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量的AgNO3处理,产生0.01mol AgCl沉淀,此氯化铬最可能是( )
A. [Cr(H2O)6]Cl3 B. [Cr(H2O)5Cl]Cl2·H2O
C. [Cr(H2O)4Cl2]Cl·2H2O D. [Cr(H2O)3Cl3]·3H2O
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家研制出一种新的分子,它具有类似白磷状结构,且分子中每个原子都满足8电子稳定结构,化学式为N4 , 下列说法正确的是( )
A.N4是一种新型化合物
B.N4和N2互为同素异形体
C.N4分子和N2一样含有N≡N
D.N4中含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可形成多种化合物,在工业生产中具有重要价值。 请回答下列问题:
(1)已知拆开1mol H-H 键,1mol N-H键, 1mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,且该反应为可逆反应,则N2与H2反应合成NH3的热化学方程式为_________。
(2)一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行合成氨反应,
①下列描述能说明该可逆反应达到化学平衡状态的有___________
A.容器内气体的密度不变 B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C.容器内的压强不变 D.3v正(H2) =2v逆(NH3)
E. 容器内气体的平均相对分子质量不变
F. 相同时间内有3molH-H键断裂,有6mol N-H键形成
②恒温恒压条件下,为提高合成氨反应中N2和H2的利用率,可以采用的方法有________________。
(3)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g)![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①20s内,v(NO2)=___________,该温度下反应的化学平衡常数数值为_________。
②升高温度时,气体颜色加深,则正反应是_________(填“放热”或“吸热”)反应。
③相同温度下,若开始向该容器中充入0.40 mol NO2,则达到平衡后: c(NO2)_____0.15 mol·L-1(填“>”、 “=”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,将同种规格的铝片分别投入下列物质中,生成氢气的反应速率最大的是( )
A.0.1mol/L盐酸15mL
B.0.2mol/L盐酸12mL
C.0.15mol/L硫酸8mL
D.18mol/L硫酸15mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,表中所列字母分别代表一种元素.

试回答下列问题:
(1)以上元素中,属于d区元素的是________(填元素符号),h在周期表的位置是_________。
(2)由e、f以原子个数1∶1形成的晶体中,化学键类型为______________。
(3)元素k的基态原子电子排布式为__________;画出c的核外电子排布图:_____________。
(4)元素c的电负性______元素g的电负性(填“>”、“=”、“<”),元素b、c、e的第一电离能由大到小的顺序是___________________(用元素符号表示)。
(5)工业上冶炼g元素的单质的化学方程式_______________________________,f、 h两种元素最高价氧化物对应的水化物反应的化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是( )

A. 该过程是电能转化为化学能的过程
B. 铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O
C. 一段时间后,① 池中n(KHCO3)不变
D. 一段时间后,② 池中溶液的pH一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯内盛有浓HNO3,在烧杯中放入用铜线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余。下列有关说法正确的是( ) .
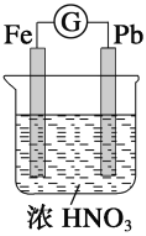
A. Fe比Pb活泼,始终作负极
B. Fe在浓HNO3中钝化,始终不会溶解
C. 电池停止工作时,烧杯中生成了Fe(NO3)3
D. 利用浓HNO3作电解质溶液不符合“绿色化学”思想
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com