
| 物质 | 杂质 | 除杂质所用试剂和方法 | |
| A | KCl溶液 | I2 | CCl4,萃取分液 |
| B | CO2 | HCl | 饱和NaHCO3溶液,洗气 |
| C | FeCl3溶液 | FeCl2 | 过量还原铁粉,过滤 |
| D | Mg粉 | Al粉 | 足量NaOH溶液,过滤 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、该醇分子中一定具有甲基 |
| B、该醇分子中一定没有甲基 |
| C、该醇分子中至少含有三个碳原子 |
| D、该醇分子中具有两个醇羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
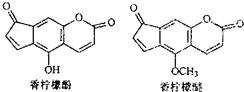
| A、香柠檬醚的分子式为C13H6O4 |
| B、1mol香柠檬酚最多可与2mol Br2发生反应 |
| C、香柠檬酚通过取代反应可转化成香柠檬醚 |
| D、1mol香柠檬酚在NaOH溶液中,最多能消耗2mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用NaOH溶液区分乙醇和乙醛 |
| B、可用饱和Na2CO3溶液除去CO2中的SO2 |
| C、实验室用浓硫酸干燥Cl2或H2 |
| D、仅用新制Cu(OH)2检验淀粉水解程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠熔化或氯化氢溶于水时都要破坏化学键 |
| B、常温常压下,18g D2O含有6.02×1024个电子 |
| C、标准状况下,11.2L SO3所含3.01×1023个分子 |
| D、离子化合物中可能含有共价键,共价化合物中一定不含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在化合物中呈+2价 |
| B、单质能与水反应放出氢气 |
| C、氢氧化镭比氢氧化钙的碱性弱 |
| D、碳酸镭难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COONH4的电离方程式为:CH3COONH4═CH3COO-+NH4+ | ||||
| B、NaHS的水解方程式为:HS-+H2O═S2-+H3O+ | ||||
| C、次氯酸的结构式为:H-O-Cl | ||||
D、过量Fe粉与Cl2反应的化学方程式为:Fe+Cl2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(N2)c2(CO2) |
| c2(CO)c2(NO) |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| c(NO)/mol | 1.00 | 0.450 | 0.250 | 0.150 | 0.100 | 0.100 | 0.092 |
| c(CO)/mol | 3.600 | 3.050 | 2.850 | 2.750 | 2.700 | 2.700 | 2.692 |
| c(N2)/mol | 0 | 0.275 | 0.375 | 0.425 | 0.450 | 0.450 | 0.454 |
| c(CO2)/mol | 0 | 0.550 | 0.750 | 0.850 | 0.900 | 0.900 |
| 生成SO2的质量(g) | 生成SO2的质量(g) | |
| 3g硫在空气中燃烧 | 5.64~5.70 | 0.375~0.45 |
| 3g硫在纯氧气中燃烧 | 5.82~5.88 | 0.15~0.225 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com