
下列说法正确的是( )
A. 摩尔是物质的数量单位,含有6.02×1023个微粒的物质叫做1摩尔
B. 1mol氧含有6.02×1023个氧原子
C. 在标准状况下,任何物质的摩尔体积约为22.4L/mol
D. 一定质量的气体的体积随压强增大和温度降低而变小
考点: 物质的量的单位--摩尔;气体摩尔体积.
专题: 化学用语专题.
分析: A、摩尔是物质的量的单位,含有6.02×1023个微粒的物质其物质的量约是1mol;
B、使用物质的量必须指明具体的物质或化学式;
C、在标准状况下,气体的摩尔体积约22.4L/mol.任何物质不都是气体;
D、气体的质量一定,则气体的物质的量一定,影响气体的体积因素有压强、温度.
解答: 解:A、摩尔是物质的量的单位,含有6.02×1023个微粒的物质其物质的量约是1mol,故A错误;
B、1mol氧指代不明确,是指氧气还是氧原子不明确,使用物质的量必须指明具体的物质或化学式,故B错误;
C、摩尔体积单位是L/mol,任何物质不都是气体.在标准状况下,气体的摩尔体积约22.4L/mol,故C错误;
D、气体的质量一定,则气体的物质的量一定,根据pV=nRT可知,体积随压强增大和温度降低而变小,故D正确.
故选:D.
点评: 考查物质的量、气体摩尔体积的理解,难度不大,注意气体摩尔体积的使用条件与对象,可借助pV=nRT理解气体摩尔体积.


科目:高中化学 来源: 题型:
铜粉放入稀硫酸溶液中,加热后无明显现象发生.当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出.该盐是( )
|
| A. | Fe2(SO4)3 | B. | Na2CO3 | C. | KNO3 | D. | FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
| W | X | Y | Z | |
| 结构 或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(1)Z在元素周期表中位于 族.
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其它三种物质发生化学反应,该元素是 (填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是 (填序号).
a.自然界中的含量 b.相应氯化物水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因: ,原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y.
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是 ,混合后溶液中离子浓度由大到小的顺序是 .
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.

能确定混合物中Y的质量分数的数据有 (填序号).
a.m、n b.m、y c.n、y.
查看答案和解析>>
科目:高中化学 来源: 题型:
选择下列实验方法分离物质,将分离方法的序号填在横线上.
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
(1)分离粗盐中混有的泥沙 . (2)分离碘和水的混合物 .
(3)分离水和汽油的混合物 . (4)分离酒精和水的混合物 .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图:A处通入氯气.关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断正确的是( )
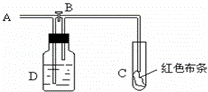
A. D中不可能是浓硫酸 B. 通入的氯气含有水蒸气
C. D中不可能是NaOH溶液 D. D中可以是饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与材料、生活和环境密切相关.下列有关说法中错误的是()
A. 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
B. 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性
C. 大力实施矿物燃料脱硫脱硝技术以减少硫、氮氧化物排放
D. 新型材料聚酯纤维、光导纤维都属于有机高分子
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素A、B、C、D的性质或结构信息如下.
①原子半径大小:A>B>C>D
②四种元素之间形成的某三种分子的比例模型及部分性质如下:

请根据上述信息回答下列问题.
(1)C元素在周期表中的位置 ,请写出D2C2分子的结构式 ,A元素的单质与物质甲发生反应的离子方程式 .
(2)丁物质与乙互为同系物,在相同条件下其蒸气的密度是氢气密度的36倍,且核磁共振氢谱只有
1组峰,写出丁物质的结构简式 .
(3)A与同周期的E元素组成的化合物EA5在热水中完全水解生成一种中强酸和一种强酸,该反应的化学方程式是 .
(4)以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,该同学想在装置Ⅱ中实现铁上镀铜,则a处电极上发生的电极反应式 ,一段时间后,测得铁增重128g,此时b极通入气体的体积是 L(标准状况下).
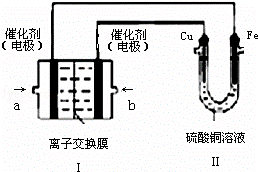
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)===Si(s)+4HCl(g)ΔH=+Q kJ·mol-1(Q>0)某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol·L-1,则H2的反应速率为
0.03mol·L-1·min-1
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH溶液中恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在298 K、100 kPa时,已知:2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com