
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源:2017届湖北省八校高三第二次联考(3月)理综化学试卷(解析版) 题型:简答题
我国是干电池的生产和消费大国。某科研团队设计了以下流程对碱性锌锰干电池的废旧资源进行回收利用:

已知:①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8
⑴碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+ Zn+2KOH= 2MnOOH+K2ZnO2,请写出电池的正极反应式_____________;
⑵为了提高碳包的浸出效率,可以采取的措施有________________________;(写一条即可)
⑶向滤液1中加入MnS的目的是__________________________________________;
⑷已知MnSO4的溶解度曲线如图所示,从滤液2中析出MnSO4·H2O晶体的操作是蒸发结晶、____________________、洗涤、低温干燥;
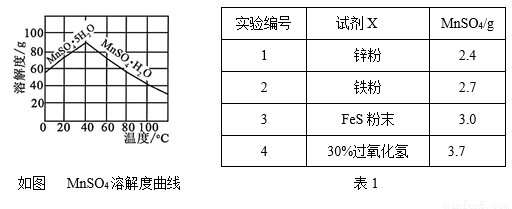
⑸为了选择试剂X,在相同条件下,分别用3 g碳包进行制备MnSO4的实验,得到数据如表1,请写出最佳试剂X与碳包中的主要成分发生反应的化学方程式_____________。
⑹工业上经常采用向滤液2中加入NaHCO3溶液来制备MnCO3,不选择Na2CO3溶液的原因是___________________________________;
⑺该科研小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为Y2-)进行络合滴定测定Mn2+在电池中的百分含量,化学方程式可以表示为Mn2++Y2-=MnY。实验过程如下:
准确称量一节电池的质量平均为24.00g,完全反应后,得到200.00mL滤液2,量取10.00mL滤液2稀释至100.00mL,取20.00mL溶液用0.0500mol•L-1EDTA标准溶液滴定,平均消耗标准溶液22.00mL,则该方案测得Mn元素的百分含量为________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高一3月月考化学试卷(解析版) 题型:简答题
安全气囊是行车安全的重要设施。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客。为研究安全气囊工作的化学原理,取安全装置中的粉末进行研究。经实验分析,确定该粉末是一种混合物且只含Na、Fe、N、O四种元素。
(1)氧元素在元素周期表中的位置是__________________,Na原子结构示意图为_____________,其中三种主族元素的离子半径从大到小的顺序是___________________(用离子符号表示)。
(2)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐晶体中含有的化学键类 型是____________________。
型是____________________。
(3)水溶性实验表明,安全气囊中固体粉末部分溶解,不溶物为一种红棕色固体,可溶于盐酸,写出反应的化学方程式_______________________________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高一3月月考化学试卷(解析版) 题型:选择题
现有X、Y两种第ⅤA族元素,下列事实不能说明X的非金属性比Y 强的是( )
强的是( )
A. 两种元素所形成的酸的酸性:H3XO4>H3YO4
B. 两种元素所形成的气态氢化物的稳定性:XH3>YH3
C. 两种元素所形成的最高价氧化物的稳定性:X2O5>Y2O5
D. 两种元素形成的气态氢化物的难易程度:X易于 Y
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次摸底考试理综化学试卷(解析版) 题型:简答题
甲醇是重要的化工原料,也是一种优质的燃料。
Ⅰ.甲醇脱氢制取甲醛的原理为CH3OH(g) HCHO(g) +H2(g)。某科研小组在2 L密闭容器中充入1 mol CH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示。
HCHO(g) +H2(g)。某科研小组在2 L密闭容器中充入1 mol CH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示。

(1)下列选项中,能说明该反应达到平衡状态的是__________;
a.v(CH3OH) =v(HCHO) b.H2的体积分数不再变化
c.甲醛的质量分数不再改变 d.混合气体密度不变
(2)在t1时,该反应的平衡常数为K=________________,此温度下,从反应开始到平衡所经过的时间为5 s,则v(HCHO)为_______mol/(L·min)。向此容器中再通入1.1 mol CH3OH和1.1 mol H2,则平衡向_________(填“正反应”或“逆反应”)方向移动;
(3)600 K时,Y点甲醇的v(正)_______v(逆) (填“>”、“<”或“=”),理由是_____________________;
Ⅱ.已知:CH3OH(g) +CuO(s)=HCHO(g) +Cu(s)+H2O(g) ΔH1=-a kJ/mol;
2Cu(s)+O2(g)=2CuO(s) ΔH2=-b kJ/mol;
(4)则在铜作催化剂时:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ΔH3=______kJ/mol(用含a,b的代数式表示);
Ⅲ.如图所示是以NaOH溶液为电解质溶液的甲醇燃料电池:

(5)a极电极反应式为__________________________,若隔膜为阴离子交换膜,则电池工作一段后,电池负极区溶液中n(OH-)_____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2017届上海市普陀区高三第二学期质量调研(二模)化学试卷(解析版) 题型:实验题
实验室中模拟纯碱工业制法,进行了如下三步实验:①将CO2、NH3通入H2O中制得NH4HCO3,②NH4HCO3和饱和食盐水反应生成小苏打,③将小苏打制成纯碱。
(1)步骤①先通入水中的气体是______。析出NH4HCO3的反应有两步,第二步反应的离子方程式为____________________。
(2)步骤②生成了含少量NaCl的小苏打,现用滴定法测定其中NaHCO3的含量。过程为:称取一定质量样品,配成250mL溶液,取出25.00mL用0.1000mol/L的盐酸滴定。实验中所写的定量仪器除滴定管外,还有_______、_______。所用的指示剂是______________。
(3)步骤②生成了含少量NaHCO3的纯碱。若用重量法(限用试剂:稀盐酸)测定其中Na2CO3含量,请设计实验方案:_______________________。若该样肠中NaHCO3含量的准确值为99.5%,而上述实验结果为97.6%,则测定的相等误差为___________,可能造成该实验误差的原因是________________。
查看答案和解析>>
科目:高中化学 来源:2017届上海市普陀区高三第二学期质量调研(二模)化学试卷(解析版) 题型:选择题
下列各项应用涉及的化学原理完全相同的是
A. 用氯化铁或液氯处理废水 B. 用铁槽车或铝槽车运输浓硫酸
C. 用二氧化硫或氯气漂自织物 D. 用亚硫酸钠或氯水处理二氧化硫尾气
查看答案和解析>>
科目:高中化学 来源:2017届山西省太原市高三模拟考试(一)理综化学试卷(解析版) 题型:填空题
CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为_________,S、O、N三种元素的第一电离能由大到小的顺序为_________。
(2)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4] (NO3)2。其中NO3-中心原子的杂化轨道类型为_________,[Cu(NH3)4]NO3)2中存在的化学键类型除了极性共价键外,还有_________。
(3)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,CN-中提供孤电子对的原子是_________, lmol CN-中含有的π键的数目为_________。与CN-互为等电子体的离子有_________ (写出一种即可)
(4)CuSO4的熔点为560°C,,Cu(NO3)2的溶点为115°C,CuSO4溶点更高的原因是_________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O ,其晶胞结构如图所示。

该晶胞原子坐标参数A为(0,0,0);B为(1,0,0) ;C为( ,
, ,
, )。则D原子的坐标参数为_________,它代表_________原子(填元素符号)。
)。则D原子的坐标参数为_________,它代表_________原子(填元素符号)。
②已知金属铜的堆积方式是面心立方最密堆积,则晶体中铜原子的配位数是_________,该晶胞中Cu原子的空间利用率是_________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A. pH<7.0的降水通常称为酸雨 B. 燃煤时加入适量石灰石,可减少废气中SO2的量
C. 新制氯水经光照一段时间酸性减弱 D. 测定氯水的pH应用干燥的pH试纸,不能用蒸馏水润湿
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com