
已知在同一条件下进行的下列两个反应:
A(s)+B(g)=C(g)+H2O(l) △H=-xkJ·mol-1
A(s)+B(g)=C(g)+H2O(g) △H=-ykJ·mol-1
试判断x、y的相对大小: 。
若上述两反应的热化学方程式改为如下情况,则x、y的相对大小又会如何?
A(s)+B(g)=C(g)+H2O(l) △H=+xkJ·mol-1
A(s)+B(g)=C(g)+H2O(g) △H=+ykJ·mol-1
(x、y均为大于0的合理数值)
科目:高中化学 来源: 题型:
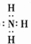
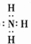
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省乐山市高三第二次调查研究考试理科综合试卷(化学部分) 题型:填空题
(17分)
A、B、C、D、E是位于前三周期的五种元素,原子序数依次增大,其中B与D为同一主族元素,它们可形成化合物DB2、DB3。在同周期元素中,C的金属性最强,E的非金属性最强。请回答:
(1)E的原子结构示意图为。
(2)A、B形成的原子个数比为1∶1的化合物的电子式为,该化合物与DB2化合生成一种强酸的化学方程式为。
(3)已知在一定条件下1 mol气态DB2完全转化为气态DB3,放出98.3 kJ的热量。该反应的热化学方程式是,工业上进行这一反应的设备是。
(4)用铂做电极电解由C、E形成化合物的饱和溶液时,检验阳极产物的实验方法为;电解一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是。工业中实际常采用阳离子交换膜电解槽进行电解,若某一电极由碳钢网制成,则该电极为电解槽的 (填“阴”或“阳”)极。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在同一条件下进行的两个反应:
① A+B = C + H2O l, 放出热量Q1 ;;
② A+B = C + H2O g, 放出热量Q2 ;
试判断Q1 和Q2的相对大小 。若上述两反应吸收的热量分别是Q1 和Q2,,则Q1 和Q2的相对大小是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com