
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )
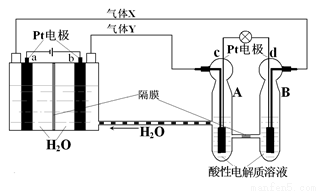
A.转移0.1mol电子时,a电极产生1.12LH2。
B.b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH-
C.c电极上发生还原反应,B电池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届广东省高三10月月考化学卷(解析版) 题型:实验题
甲酸正丁酯是重要的有机原料,可通过酯化反应制得。已知A的核磁共振氢谱吸收峰的高度比为3:2:2:1,丙烯在通常条件下稳定,但遇强氧化剂时容易被氧化生成CO2。
Ⅰ.正丁醇(CH3CH2CH2CH2OH)的制备。
某研究性学习小组为合成正丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2 A(液态)
A(液态)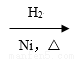 正丁醇;
正丁醇;
(1)已知反应1的原子理论利用率为100%,请写出A的结构简式 。
(2)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 (填序号,试剂可以重复使用)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液
③石灰水 ④无水CuSO4 ⑤品红溶液
Ⅱ.甲酸正丁酯的合成。
某研究性学习小组利用如图装置进一步合成甲酸正丁酯。

(3)大试管中溶液的作用除了溶解正丁醇外,还有 。
(4)若大试管中溶液是NaOH溶液,则收集到的产物比预期的少,其原因是 。
(5)已知反应结束后烧瓶中是甲酸、正丁醇、甲酸正丁酯和硫酸的混合物,为了回收大量未反应的甲 酸和正丁醇,该研究性小组根据相关理化性质设计以下分离操作步骤流程图。
甲酸 | 正丁醇 | 甲酸正丁酯 | |
熔点/℃ | 8.4 | -88.9 | -91 |
沸点/℃ | 100.8 | 117.7 | 107 |
溶解性 | 三者能相互溶解。 | ||
上述流程图中,操作1是 ,试剂b是 。
查看答案和解析>>
科目:高中化学 来源:2017届四川省泸州市高三上10月月考化学卷(解析版) 题型:选择题
研究人员发现了一种“水”电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是( )
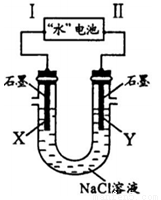
A.I为负极,其电极反应式为Ag+Cl-+e-=AgCl
B.“水”电池内Na+不断向负极作定向移动
C.每转移1mole-,U型管中消耗0.5molH2O
D.“水”电池内,每生成1molNa2Mn5O10,X电极上生成1mol气体
查看答案和解析>>
科目:高中化学 来源:2017届山西省大同市高三上学期第一次调研化学试卷(解析版) 题型:填空题
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
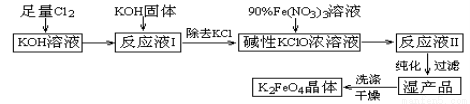
已知:
①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2 FeO4可作为新型多功能水处理剂的原因是 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为 ;
(5)在“反应液I”中加KOH固体的目的是 :
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品 (写化学式)。
(7)该工艺每得到1.98 kg K2FeO4,理论上消耗Cl2的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源:2017届山西省大同市高三上学期第一次调研化学试卷(解析版) 题型:选择题
下列化学符号正确的是( )
A.二氧化硅的结构式O=Si=O
B.聚乙烯的结构简式
C.过氧化钠的电子式
D.羟基的电子式
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期10月质检化学试卷(解析版) 题型:选择题
从下列事实所列出的相应结论正确的是( )
实 验 事 实 | 结 论 | |
① | SO2使酸性高锰酸钾溶液退色 | 可证明SO2有漂白性 |
② | 用磨口玻璃瓶保存NaOH溶液,用热的纯碱溶液清洗容器里附 | 都发生了氧化还原反应 |
③ | 取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀滴加稀盐酸,沉淀不溶解, | 证明Na2SO3已氧化变质 |
④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
A.①② B.③④ ⑤ C. ②④ D.④ ⑤
查看答案和解析>>
科目:高中化学 来源:2017届山东省栖霞市高三上学期期中化学试卷(解析版) 题型:实验题
过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:

已知:CaO2·8H2O呈白色微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全。
(1)写出反应①屮氧化还原反应的离子方程式___________________。
(2)向反应①后的溶液中加浓氨水的目的是_________________。
(3)写出反应②的化学方程式_________________;反应②常用冰水控制温度在0℃左右.其可能原因是(写出两种):
①________________;②________________。
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加人适量蒸馏水和过量的b gKI晶体,再滴人少量2 mol • L-1H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加人几滴淀粉溶液。
第三步:逐滴加入浓度为c mol • L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。已知:I2+2S2O32- =2I-+S4O62-。
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能__________(填“不受影响”“偏低”或“偏高”),原因是________________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期10月月考化学试卷(解析版) 题型:实验题
二氧化氯ClO2是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是_________________。
(2)我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示.(其中 表示氯原子,
表示氯原子, 表示钠原子,
表示钠原子, 表示氧原子)请写出反应的化学方程式_____________
表示氧原子)请写出反应的化学方程式_____________

(3)消毒水时,ClO2还可将Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,请写出二氧化氯与Mn2+反应的离子方程式____________________。
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样用氢氧化钠溶液调至中性,然后加入一定量的碘化钾,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2=S4O62-+2I-)
Ⅲ.重复上述操作2~3次。

操作时,不同pH环境中粒子种类如下图所示:请回答:
①操作Ⅰ中反应的离子方程式是______________________。
②若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是________mg·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com