
【题目】A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当A,B的物质的量之比为1:4且A为黑色固体时,该反应的离子方程式是;
②当A,B的物质的量之比为1:6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移: .
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示) .
(2)若A为单质,B为无色油状黏稠液体,当 A,B的物质的量之比为1:2时,则A可能为 , 检查其中刺激性气体产物X的方法是 .
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1:4反应.
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为 .
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1:2时,则被还原的X是mol.
(4)若A,B,X,Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 .
(5)若A,B,X,Y均为化合物.X为极易溶于水的气体,则盐A是盐,生成气体X的离子方程式为 , 检验该气体的方法是 .
【答案】
(1)MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;![]() ;4HSO3﹣+Cl2=SO42﹣+2Cl﹣+3SO2↑+2H2O
;4HSO3﹣+Cl2=SO42﹣+2Cl﹣+3SO2↑+2H2O
(2)C或Cu;将气体X通入品红溶液中,若品红溶液褪色,证明气体X是SO2
(3)0.3mol/L;![]() a或
a或 ![]() a
a
(4)NaAlO2、NaCl
(5)铵;NH4++OH﹣ ![]() NH3↑+H2O;将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口若试纸变蓝,则说明该气体为氨气
NH3↑+H2O;将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口若试纸变蓝,则说明该气体为氨气
【解析】解:(1)若Y是黄绿色气体,则Y为氯气.①当A、B的物质的量之比为1:4且A为黑色固体时,该反应为二氧化锰与浓盐酸制备氯气,反应离子方程式为:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O,所以答案是:MnO2+4H++2Cl﹣
Mn2++Cl2↑+2H2O,所以答案是:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;②当 A、B的物质的量之比为1:6时,则该反应为浓盐酸与氯酸钾反应来制取氯气,并用双线桥表示反应过程中的电子转移为
Mn2++Cl2↑+2H2O;②当 A、B的物质的量之比为1:6时,则该反应为浓盐酸与氯酸钾反应来制取氯气,并用双线桥表示反应过程中的电子转移为 ![]() ,所以答案是:
,所以答案是: 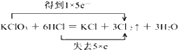 ;③溶液中氯气将亚硫酸氢钠氧化,溶液中会生成硫酸,硫酸与亚硫酸钠反应生成二氧化硫,会污染空气,反应离子方程为:4HSO3﹣+Cl2=SO42﹣+2Cl﹣+3SO2↑+2H2O,所以答案是:4HSO3﹣+Cl2=SO42﹣+2Cl﹣+3SO2↑+2H2O;(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1:2时,A为碳灰Cu,B为浓硫酸,反应生成气体X为二氧化硫,检验二氧化硫的方法为:将气体X通入品红溶液中,若品红溶液褪色,证明气体X是SO2 , 所以答案是:C或Cu;将气体X通入品红溶液中,若品红溶液褪色,证明气体X是SO2;(3)常温下A在B的浓溶液中会“钝化”,A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水,X为3Fe(NO3)3 , Y为NO.①100mL 2mol/L的硝酸溶液中含硝酸0.2mol,Fe过量充分反应后得到硝酸亚铁溶液,根据反应3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O可知,硝酸亚铁的物质的量为
;③溶液中氯气将亚硫酸氢钠氧化,溶液中会生成硫酸,硫酸与亚硫酸钠反应生成二氧化硫,会污染空气,反应离子方程为:4HSO3﹣+Cl2=SO42﹣+2Cl﹣+3SO2↑+2H2O,所以答案是:4HSO3﹣+Cl2=SO42﹣+2Cl﹣+3SO2↑+2H2O;(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1:2时,A为碳灰Cu,B为浓硫酸,反应生成气体X为二氧化硫,检验二氧化硫的方法为:将气体X通入品红溶液中,若品红溶液褪色,证明气体X是SO2 , 所以答案是:C或Cu;将气体X通入品红溶液中,若品红溶液褪色,证明气体X是SO2;(3)常温下A在B的浓溶液中会“钝化”,A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水,X为3Fe(NO3)3 , Y为NO.①100mL 2mol/L的硝酸溶液中含硝酸0.2mol,Fe过量充分反应后得到硝酸亚铁溶液,根据反应3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O可知,硝酸亚铁的物质的量为 ![]() ×0.2mol=0.075mol,将溶液稀释至500mL后溶液中硝酯根离子的物质的量浓度为
×0.2mol=0.075mol,将溶液稀释至500mL后溶液中硝酯根离子的物质的量浓度为 ![]() mol/L=0.3mol/L,所以答案是:0.3mol/L;②含 a mol Fe(NO3)3的溶液溶解了一定量Fe后,发生的反应为2Fe3++Fe═3Fe2+ , 溶液中两种金属阳离子的物质的量之比为1:2,若n(Fe3+):n(Fe2+)=1:2,设被还原的Fe(NO3)3是xmol,则(a﹣x):
mol/L=0.3mol/L,所以答案是:0.3mol/L;②含 a mol Fe(NO3)3的溶液溶解了一定量Fe后,发生的反应为2Fe3++Fe═3Fe2+ , 溶液中两种金属阳离子的物质的量之比为1:2,若n(Fe3+):n(Fe2+)=1:2,设被还原的Fe(NO3)3是xmol,则(a﹣x): ![]() x=1:2,解得x=
x=1:2,解得x= ![]() a,若n(Fe2+):n(Fe3+)=1:2,设被还原的Fe(NO3)3是ymol,则
a,若n(Fe2+):n(Fe3+)=1:2,设被还原的Fe(NO3)3是ymol,则 ![]() y:(a﹣y)=1:2,解得y=
y:(a﹣y)=1:2,解得y= ![]() a,所以答案是:
a,所以答案是: ![]() a或
a或 ![]() a;(4)若A、B、X、Y均为化合物,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,则A中含有氯离子,B的焰色为黄色,则B中含有Na元素,A与B按物质的量之比1:4恰好反应,该反应是氯化铝与氢氧化钠反应,溶液中溶质为生生成物:偏铝酸钠、氯化钠,所以答案是:NaAlO2、NaCl;(5)若A、B、X、Y均为化合物,X为极易溶于水的气体,应是铵盐与碱反应生成氨气的反应,X为氨气,盐A为铵盐,生成气体X的离子方程式为:NH4++OH﹣
a;(4)若A、B、X、Y均为化合物,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,则A中含有氯离子,B的焰色为黄色,则B中含有Na元素,A与B按物质的量之比1:4恰好反应,该反应是氯化铝与氢氧化钠反应,溶液中溶质为生生成物:偏铝酸钠、氯化钠,所以答案是:NaAlO2、NaCl;(5)若A、B、X、Y均为化合物,X为极易溶于水的气体,应是铵盐与碱反应生成氨气的反应,X为氨气,盐A为铵盐,生成气体X的离子方程式为:NH4++OH﹣ ![]() NH3↑+H2O,验该气体的方法是:将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口若试纸变蓝,则说明该气体为氨气,所以答案是:铵;NH4++OH﹣
NH3↑+H2O,验该气体的方法是:将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口若试纸变蓝,则说明该气体为氨气,所以答案是:铵;NH4++OH﹣ ![]() NH3↑+H2O;将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口若试纸变蓝,则说明该气体为氨气.
NH3↑+H2O;将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口若试纸变蓝,则说明该气体为氨气.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________________________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______。
(4)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K______1.0(填“大于”“小于”或“等于”)。
(5)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____移动(填“向正反应方向”“向逆反应方向”或“不”)。
(6)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为__________(填“正反应方向”“逆反应方向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL FeBr2溶液中通入标准状况下的Cl2 3.36L,Cl2全部被还原,最终测得溶液中c(Br﹣)是c(Cl﹣ )的一半,则原FeBr2溶液的物质的量浓度(molL﹣1)是( )
A.0.75
B.1.5
C.2
D.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学防护对预防病毒感染非常重要,下列说法错误的是
A.冠状病毒粒子直径约60-220 nm,介于溶液和胶体粒子之间
B.制作防护服和口罩的无纺布是有机高分子材料
C.免洗手消毒液的成分活性银离子、乙醇均能使蛋白质变性
D.二氧化氯泡腾片可用于水处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在透明溶液中,下列各组离子能大量共存的是
A. HCO3-、ClO-、K+、H+ B. Na+、Fe2+、NO3-、H+
C. K+、Cu2+、Cl-、SO42- D. OH-、NH4+、Cl-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+ H2O2+ BaCl2= BaSO4↓+ 2HC1 ,用NA表示阿伏加德罗常数的值,下列说法不正确的是
A. 0.1 molBaCl2中所含离子总数约为0.3 NA
B. 25℃时,pH=l的HC1溶液中含有H+的数目约为0.1 NA
C. 标准状况下,17gH2O2中所含电子总数约为9 NA
D. 生成2.33gBaSO4沉淀时,吸收SO2的体积在标准状况下约为0.224L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙变红色的溶液:Na+、Cu2+、ClO-、Cl-
B. 0.1 mol·L-1 Na2CO3溶液:K+、AlO![]() 、Cl-、SO42-
、Cl-、SO42-
C. 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:H+、Al3+、Cl-、NO![]()
D. KW/c(H+)=0.1 mol·L-1的溶液中:Ca2+、NH4+、CH3COO-、HCO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com