
����Ŀ������Դ�����ĺ��IJ���������ӵ�أ��������������(LiFePO4)���缫���ϡ���LiFePO4�Ͼɵ缫��������Al��ʯī�ۣ����ղ���øߴ�Li2CO3�Ĺ�ҵ������ͼ��

���ϣ�̼�����ˮ���ܽ�����¶ȱ仯���£�
�¶�/�� | 0 | 20 | 40 | 60 | 80 | 100 |
�ܽ��/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)����i��ĥ�����Ŀ����__________________��
(2)����ii��������NaOH��Һ������(�û�ѧ��Ӧ����ʽ��ʾ)_________________��
(3)�����iii����NaClO3��Ϊ��������������лᷴӦ�ᷢ������Ӧ���ɻ���ɫ���壬
���ø���Ӧ��Ӧ�����ӷ���ʽΪ_______________________________________________________��
�ӻ����Ƕȷ�����ѡ��___________(����ĸ)��Ϊ�ù��̵�����������á�
a.H2O2 b.Ũ���� c.ŨHNO3
������iii�õ��Ľ���Һѭ�����ε�Ŀ����________________________________________________��
(4)����Һ�д��ڴ���H2PO4����HPO42-����֪��![]() �����ƽ���ƶ�ԭ����������iv�õ������������ԭ��______________________________________��
�����ƽ���ƶ�ԭ����������iv�õ������������ԭ��______________________________________��
(5)��������vi�IJ���______________________________________________________________��
���𰸡�����Ӵ�������ӿ췴Ӧ���� 2Al + 2NaOH + 2H2O=2NaAlO2+3H2�� ClO3- +5Cl- + 6H+ = 3Cl2��+ 3H2O A �������������������ʣ�����߽���Һ��Li+Ũ�ȣ���Լ��������������� CO32�����H+��c(H+)��С��������������ƽ��������ƶ���c(PO43��)������Fe3+����γ����������� ����ˮϴ�ӡ�����
��������
��1������Ӱ�췴Ӧ���ʵ����ط�������i��ĥ�����Ŀ�ģ�
��2��������������������������Һ������
��3���ٹ���iii��NaClO3�������ᷢ����Ӧ�����������Ȼ��ơ�ˮ���ӻ����Ƕȷ���ѡ��Ի�������Ⱦ�����������������ã�
�ڽ���Һѭ�����ÿ����������������������ʣ���߽���Һ��Li+Ũ�ȣ���Լ���������������
��4������iv����̼������Һ�������c(PO43��)���Ӷ�ʵ�ֳ�����
��5�������¶�Խ��̼����ܽ��ԽС������
��1�� ����i��ĥ�����Ŀ��������Ӵ�������ӿ췴Ӧ���ʣ�
�ʴ�Ϊ������Ӵ�������ӿ췴Ӧ���ʣ�
��2�� ��������������������Һ����ƫ�����ƣ����Թ���ii��������NaOH��Һ���������ܽ�����ʹ������ȥ����Ӧ�Ļ�ѧ����ʽΪ��2Al + 2NaOH + 2H2O=2NaAlO2+3H2����
�ʴ�Ϊ��2Al + 2NaOH + 2H2O=2NaAlO2+3H2����
��3�� �ٹ���iii��NaClO3�������ᷢ����Ӧ�����������Ȼ��ơ�ˮ����Ӧ�����ӷ���ʽΪ��
ClO3- +5Cl- + 6H+ = 3Cl2��+ 3H2O������iii����H2O2����������������H2O������Ⱦ��Ũ���ᡢŨHNO3��Ϊ������������ֱ�Ϊ���������������Ⱦ���������Դӻ����Ƕȷ���ѡ��H2O2��Ϊ�ù��̵�����������ã�
�ʴ�Ϊ��ClO3- +5Cl- + 6H+ = 3Cl2��+ 3H2O��H2O2 ��
�ڹ���iii�õ��Ľ���Һѭ�����ε�Ŀ�����������������������ʣ���߽���Һ��Li+Ũ�ȣ���Լ���������������
�ʴ�Ϊ���������������������ʣ���߽���Һ��Li+Ũ�ȣ���Լ���������������
��4�� ����iv����̼������Һ�������c(PO43��)��CO32�����H+��c(H+)��С��������������ƽ��������ƶ���c(PO43��)������Fe3+����γ����������壻
�ʴ�Ϊ��CO32�����H+��c(H+)��С��������������ƽ��������ƶ���c(PO43��)������Fe3+����γ����������壻
��5�� �¶�Խ��̼����ܽ��ԽС����˹���vi�IJ���������ˮϴ�ӡ����
�ʴ�Ϊ������ˮϴ�ӡ����


 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д� Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊѡ���⣬����A��B���⡣ѡѧ����ѧ�����ģ��Ŀ�����A�⣬ѡѧ���л���ѧ������ģ��Ŀ�����B�⣬ÿλ����ֻ��ѡ��l�⡣�����ⶼ��������A��Ʒ֡�
A����ѧ�����
(1)���λ�����Ⱦ��������̬�����ѳ�Ϊȫ����Ĺ�ʶ��
�����и����У���ɿ�����������ʱ����Ҫ������______(����ĸ)��
a��������̼��Ũ�� b�����������Ũ�� c��������������Ũ��
�����������в����ڸ��ƻ�����������______(����ĸ)��
a�����Ͼɵ�ؽ���������
b��������÷��ܵ�����Դ
c����������װβ��������װ��
�۹�ҵ��ˮ�账����������ŷš����ֳ��ų��ķ�ˮ��Ҫ�Ǻ���������Է�ˮ�������˷�ˮ�ɲ��õķ�����______(����ĸ)��
a��������ԭ�� b���кͷ� c��������
��úֱ̿��ȼ��������ֻ������⡣ȼú������SO2������______�γɵĿ��ܣ�������CO��SO2�̵�����Ⱦ��һ�ַ����ǽ����ڴ���������ת��Ϊ����S��������Ӧ�Ļ�ѧ����ʽΪ_____________________��
(2)����Ӧ�û�ѧ֪ʶ���Ը��õ���ʶ����������
�ٵ����������ࡢ��֬���������У��ṩ����������______��������ˮ����Եõ�______��
������������Ѫ������Ѫ����ԭ����Ҫ����Ϊȱ��______(�ά����A������ά����C����ά����D��)��
(3)���ܸ���ĸ��ֲ��ϵĹ㷺Ӧ�ô����������ǵ�����ˮƽ���Իش����⣺

��ʯīϩ(��ͼ)������̫���ܵ�صĵ缫��������Ҫ������ʯīϩ��______�ԡ�
�ڸ�¯����������������ˮ�Ҫ�õ���ԭ����______(����ĸ)��
a. ���������������b. ʯ��ʯ������������c. ��̿
�ۡ����ߡ����������족�������������ɡ����ڵ�������Ϊ����������紦����������ɵ����ʲ㡢�ϳ����ʵصı������ܲ㡢���ϲ��Ͻṹ��ɵ������ܲ㡢�������ϵ����Ʋ㡢���Ȳ����������㡣��������Ȼ�л��߷��Ӳ�����ɵIJ���______(����ĸ)��
a. ���ʲ� b. �������ܲ� c. �����ܲ�
�ܲ����뻯ѧ������أ����ж�Ӧ��ϵ��ȷ����______(����ĸ)��
ѡ�� | ���� | ��Ҫ��ѧ�ɷ� |
a | �����ʯ | ���������� |
b | ����ʯ��ʯ��ʯ | ̼��� |
c | ���ά����ͨ���� | ������ |
��ͭ��������ʱ������ͭ��[Cu2(OH)2CO3]�����ͭ�̿��������ȥ��д���÷�Ӧ�Ļ�ѧ����ʽ________________________________��
B���л���ѧ������
(1)��ʶ�л�������Ľṹ��������������������ʡ�
�������л��������뱽����(C6H5COOH)��Ϊͬϵ�����______(����ĸ����ͬ)��
a. C6H5CH2COOH b. C6H5CH2CHO c. C6H5OH
�������л�������������ˮ����______��
a. ������ b. ���顡�� c. �Ҵ�
�������Լ������ڼ����������ȩ����______��
a. ˮ b. ������Һ c. ϡ����
(2)������(C6H5CHOHCOOH)��һ����Ҫ�Ļ���ԭ�ϡ�
�ٱ������������______�ֲ�ͬ��ѧ�������⡣
�ڱ������к��������ŵ�����Ϊ______��______��
��1 mol�������������______mol�����Ʒ�Ӧ
(3)������C��һ��ҽҩ�м��壬��ͨ�����з����ϳɣ�
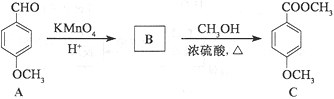
��A�к��������ŵ�����Ϊ______��______��
��B�Ľṹ��ʽΪ______��
��B��C�ķ�Ӧ����Ϊ______��
��C��ͬ���칹��D�ܷ���������Ӧ������FeCl3��Һ������ɫ��Ӧ����1molD�������2molNaOH��Ӧ��D��������4�ֲ�ͬ��ѧ�������⣬��д��D��һ�ֽṹ��ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ�У���ȷ���ǣ� ��
A.ʯ��ʯ�����ᷴӦ��CaCO3��2H����Ca2����CO2����H2O
B.����ˮ�ķ�Ӧ��![]()
C.������ͭ�������Cu2����2OH����2H����Cu2����2H2O
D.������ˮ�ķ�Ӧ�� Cl2��H2O �� 2H����Cl����ClO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϣ�������ش�����⣺

����������A�ǰ�ɫ���壻������B�Ǻ�ɫ���壻����DΪ�ж��Ļ���ɫ���壬����C���������Ũ���ᡣ
��1��D��_______��G��_______���ѧʽ��
��2��д�����з�Ӧ�����ӷ���ʽ��M+NaOH��Һ����G_____________________��G+NaOH��Һ����N______________________________________________________��
��3������C���������Ũ�����ԭ����____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�ÿ��Խ��е�ƣ�����˵������ȷ����
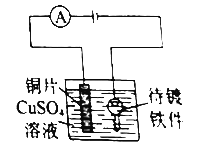
A. ���ʱ���ƵĽ�����Ʒ���������Ʋ����������
B. �ú��жƲ�������ӵ���Һ�����Һ
C. ������������Ϊ��ͭ�壬���ɽ���ͭ�ľ���
D. ��Ʒ�ˮ�ŷ�ǰ���뾭������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ⶨ![]() ��Һ�������ٽ��¹����е�
��Һ�������ٽ��¹����е�![]() ���������±���ʵ������У�ȡ�١���ʱ�̵���Һ�����������ữ��
���������±���ʵ������У�ȡ�١���ʱ�̵���Һ�����������ữ��![]() ��Һ���Ա�ʵ�飬�ܲ�����ɫ�����ࡣ����˵������ȷ����
��Һ���Ա�ʵ�飬�ܲ�����ɫ�����ࡣ����˵������ȷ����
ʱ�� | �� | �� | �� | �� |
�¶� | 25 | 30 | 40 | 25 |
| 9.66 | 9.52 | 9.37 | 9.25 |
A. ![]() ��Һ�д���ˮ��ƽ�⣺
��Һ�д���ˮ��ƽ�⣺![]()
B. �ܲ����İ�ɫ������![]()
C. �١��۵Ĺ����У�![]() �ڽ���
�ڽ���
D. �١��۵Ĺ�����,�¶���![]() ��ȣ�ǰ�߶�ˮ��ƽ���Ӱ�����
��ȣ�ǰ�߶�ˮ��ƽ���Ӱ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ![]()
![]() ��ƽ���ƶ�ʱ����ɫ�仯��������ָʾ���ȹ��̺����ȹ��̡�������ijͬѧ�IJ���ʵ�鱨�档
��ƽ���ƶ�ʱ����ɫ�仯��������ָʾ���ȹ��̺����ȹ��̡�������ijͬѧ�IJ���ʵ�鱨�档
| 1.����ձ��м��� 2.�����ձ���Ͷ��һ������ |
��1�����ձ���![]() ��ĺ���ɫ��dz��˵��ƽ��
��ĺ���ɫ��dz��˵��ƽ��![]() ��______________�������Ӧ�����淴Ӧ���������ƶ�������
��______________�������Ӧ�����淴Ӧ���������ƶ�������![]() ��������ˮ��__________________������ȡ������ȡ������̡�
��������ˮ��__________________������ȡ������ȡ������̡�
��2���������ձ��е�����ȫ![]() ��
��![]() ��Ӧ���̵������仯ʾ��ͼ_____��
��Ӧ���̵������仯ʾ��ͼ_____��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����п����Ҫ�ɷ���![]() ����������
����������![]() ���Ʊ�
���Ʊ�![]() ��һ�ֹ������̣�
��һ�ֹ������̣�
![]()
���ϣ���ؽ�������Ũ��Ϊ![]() ʱ�γ��������������
ʱ�γ��������������![]() ��Χ���£�
��Χ���£�
�������� |
|
|
|
��ʼ������ | 1.5 | 6.3 | 6.2 |
������ȫ�� | 2.8 | 8.3 | 8.2 |
��1����п�����ܽ�֮ǰ�Ὣ����飬Ŀ����______________��
��2���ܽ�����ʹ�ù�����![]() ��Һ��
��Һ��![]() ��ȡ��ۣ���������Ҫ��Ӧ�ǣ�
��ȡ��ۣ���������Ҫ��Ӧ�ǣ�
![]() �������ж���ȷ����____________������ĸ��ţ���
�������ж���ȷ����____________������ĸ��ţ���
a.����Һ�к���![]() ��������
��������
b.�������ᣬ��������![]() ˮ��
ˮ��
c.������![]() ��Һ���н�ȡ����������Ӧ��
��Һ���н�ȡ����������Ӧ��![]()
��3����ҵ����������Ҫ���Ƴ������ʣ���˷�Ϊ��ԭ�����������Ⱥ���У�����ͼ����ԭ���̽�����![]() ת��Ϊ
ת��Ϊ![]() ���õ�
���õ�![]() С��1.5����Һ��������������Һ���ȼ���������a����ͨ��
С��1.5����Һ��������������Һ���ȼ���������a����ͨ��![]() ��
��
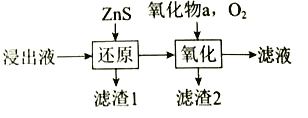
��a������______________������a��������_______________��
�ڳ��������п��Կ�����Һ��![]() �IJ�����_______________��
�IJ�����_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��R��W��ԭ���������ε��������ֶ���������Ԫ�أ���������������֮��Ϊ11������YԪ���������ͻ��ϼ۵Ĵ�����Ϊ2��Y��Z�ĵ������ɵĻ�������һ�ִ�������Ϣ�ġ���ʹ���ӡ���R��ԭ�Ӱ뾶������Ԫ�������ģ�Y��W��ͬ��Ԫ�ء�����˵��������ǣ� ��
A. �����ӵĻ�ԭ�ԣ�Y>Z
B. R�ĵ��ʿ����ǽ�����ǽ���
C. ��X��Z��W���ɵ���һ������Ԫ��
D. ��״���£�1molYZ��0.5mol![]() ��Ϻ�������������һ��С��22.4L
��Ϻ�������������һ��С��22.4L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com