
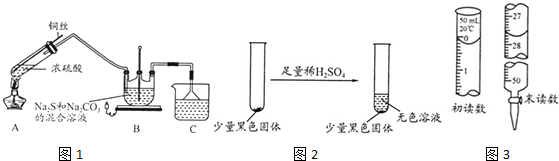
分析 (1)加热条件下,Cu和浓硫酸反应生成CuSO4、SO2和H2O;
(2)SO2有毒,不能直接排空,且为酸性氧化物,能和碱溶液反应生成无毒亚硫酸盐;还可以将Cu和浓硫酸分离而停止反应;
(3)Cu2O呈砖红色;CuO能溶于稀硫酸生成蓝色CuSO4溶液,黑色固体CuS不溶于稀硫酸;
(4)①碘遇淀粉试液变蓝色;
②V(Na2S2O3)=(27.60-0.10)mL,根据该反应中2S2O32-----I2计算碘的物质的量浓度.
解答 解:(1)加热条件下,Cu和浓硫酸反应生成CuSO4、SO2和H2O,反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)SO2有毒,不能直接排空,且为酸性氧化物,能和碱溶液反应生成无毒亚硫酸盐,所以可以碱液吸收二氧化硫尾气,如NaOH溶液;还可以将Cu和浓硫酸分离而停止反应,
故答案为:NaOH溶液;将铜丝抽离液面停止反应;
(3)Cu2O为砖红色不是黑色,所以②一定不成立;CuO能溶于稀硫酸生成蓝色CuSO4溶液,黑色固体CuS不溶于稀硫酸,所以该黑色固体是CuS,
故答案为:Cu2O为砖红色;CuS;
(4)①碘遇淀粉试液变蓝色,如果滴入最后一滴,溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点,故答案为:滴入最后一滴,溶液由蓝色变为无色,且半分钟内不变色;
②V(Na2S2O3)=(27.60-0.10)mL=27.50mL,设碘的物质的量浓度是xmol/L,
I2------2S2O32-
1mol 2mol
0.0275xmol (0.025×0.0030)mol
1mol:2mol=0.0275xmol:(0.025×0.0030)mol
x=$\frac{(0.025×0.0030)mol×1mol}{2mol×0.0275mol}$=0.0014,
故答案为:0.0014mol/L.
点评 本题考查性质实验方案设计,涉及离子方程式的计算、氧化还原反应、物质判断等知识点,侧重考查学生分析判断及计算能力,注意滴定管读数方法,题目难度不大.


科目:高中化学 来源: 题型:填空题
 ;A的最高价氧化物对应水化物的化学式为HNO3.
;A的最高价氧化物对应水化物的化学式为HNO3.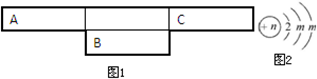
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
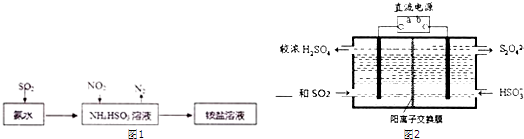
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
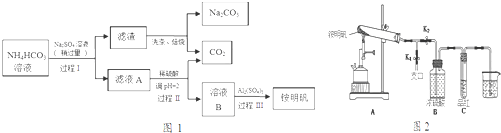
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
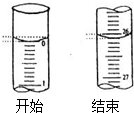 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 20.00 | 0.00 | 26.01 |
| 第二次 | 20.00 | 1.56 | 30.30 |
| 第三次 | 20.00 | 0.22 | 26.21 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
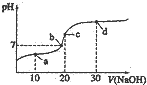 25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1
25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1 | A. | a点:c(CH3COO-)<c(Na+) | |
| B. | 水的电离程度:c点小于d点 | |
| C. | b点时,NaoH和CH3COOH恰好完全反应 | |
| D. | d点:c(OH-)-c(H+)+c(CH3COOH)=0.2 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com