
下列说法不正确的是
A. 乙烯的产量是衡量一个国家石油化工发展水平的标志
B. 1mol CH3COOH与1mol CH3CH2OH在浓硫酸共热下生成乙酸乙酯分子数为NA
C. 分子式为C5H12O的醇类有8种结构
D. 苯在空气中燃烧时冒浓烟,说明苯组成中含碳量较高
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源:2016-2017学年山西省大同市高二3月月考化学试卷(解析版) 题型:选择题
下列说法中正确的是
A. 基态原子是处于最低能量状态的原子
B. 基态C原子的电子排布式是1s22s12p3
C. 焰色反应是金属原子的电子从基态跃迁到激发态时产生的光谱
D. 同一原子处于激发态时的能量一定低于基态时的能量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二下学期第一次阶段性考试化学试卷(解析版) 题型:计算题
现有A、B两份混合气体,A是烯烃R与足量O2的混合气体;B是烯烃R、炔烃Q与足量O2的混合气体。取A、B各2.24L分别引燃,A充分燃烧后气体总体积仍为2.24L,B充分燃烧后气体总体积为2.34L(燃烧后的产物均为气态,其体积已换算成标准状况)。通过计算,写出:
(1)烯烃R的分子式____________________。
(2)炔烃Q的分子式____________________。
(3)求2.24L B中烯烃R所允许的最大体积是_________L。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二下学期第一次阶段性考试化学试卷(解析版) 题型:选择题
苯环实际上不具有碳碳单键和双键的交替结构,可以作为证据的事实有 ( )
①苯的间位二取代物只有一种 ②苯的邻位二取代物只有一种
③苯分子中碳碳键的键长均相等 ④苯不能使酸性KMnO4溶液褪色
⑤苯在加热和催化剂存在条件下,与氢气发生加成反应
⑥苯在FeBr3存在的条件下,与液溴发生取代反应,但不能因化学变化而使溴水褪色
A. ①②③④ B. ②③④⑥ C. ③④⑤⑥ D. 全部
查看答案和解析>>
科目:高中化学 来源:2017届贵州省凯里市高三3月联考理综化学试卷(解析版) 题型:简答题
亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:

已知:①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出。
②ClO2气体在中性和碱性溶液中不能稳定存在。
回答下列问题:
(1)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的_________(填化学式),至沉淀不再产生后。再加入过里的Na2CO3和NaOH,充分反应后将沉淀一并滤去。在无隔膜电解槽中用惰性电极电解一段时间生成NaClO3,阳极反应式为_______
(2)X酸是_________。写出二氧化氯发生器中生成ClO2的化学方程式_______,吸收塔内的温度不宜过高的原因为________
(3)亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2有毒,经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析正确的是(_____)
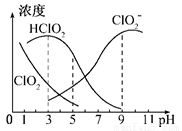
A.亚氯酸钠在碱性条件下较稳定
B.25℃时,HClO2的浓度随PH增大而增大
C.PH=6时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 25℃时,该溶液在pH=4时比pH=2时更适合漂白
(4)aKg 30%的双氧水理论上可最多制得___Kg NaClO2·3H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省北校高一3月月考化学试卷(解析版) 题型:填空题
试分析下列各种情况下微粒间作用力的变化情况(填“离子键”“极性键”“非极性键”或“分子间作用力”):
(1)NaCl溶于水时破坏___________________________________;
(2)HCl溶于水时破坏____________________________________;
(3)SO2溶于水时破坏____________________________________;
(4)酒精溶于水时破坏____________________________________;
(5)NaOH和HCl反应时形成_______和_______;
(6)反应2H2+O2=2H2O中,被破坏的是________,形成的是________;
(7)CaCl2和Na2CO3反应时,被破坏的化学键有________,形成的化学键有________;
(8)Na2O熔化时被破坏的是________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省北校高一3月月考化学试卷(解析版) 题型:选择题
下列叙述中能肯定A金属比B金属金属性强的是( )
A. A原子的最外层电子数比B原子的最外层电子数少
B. A原子的电子层数比B原子的电子层数多
C. 1mol A从酸中置换H+生成的H2比1mol B从酸中置换H+生成的H2多
D. 常温时,A能从水中置换出氢,而B不能
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(二)化学试卷(解析版) 题型:推断题
A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)E+离子的电子排布式是 。
(2)B、C、D元素的第一电离能由大到小的顺序是 。
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是 ;B、C的这些氢化物的沸点相差较大的主要原因是 。
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是 ;1 mol该分子中含有π键的数目是 。
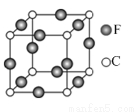
(5)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,C原子的配位数是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是
A.用Pt电极电解少量的CuC12溶液:2H2O+Cu2++2Cl- 通电 H2↑+C12↑+Cu(OH)2↓
B.0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
C.酸性高锰酸钾溶液中滴加H2O2溶液4MnO4- + 4H2O2 + 12H+ = 4Mn2+ + 7O2↑+ 10H2O
D.向磁性氧化铁中加入氢碘酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com