
(1)M是什么金属?
(2)电解过程中,导线上流过的电子个数是多少?
(3)最初配制的溶液中,该金属离子物质的量浓度是多少?
(4)若此电解液在电解后体积为40 mL,此时溶液的pH是多少?
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:阅读理解
| 9(b-a) |
| a |
| 9(b-a) |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
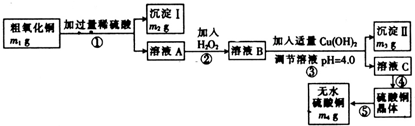
m1-m2-
| ||
| m1 |
m1-m2-
| ||
| m1 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 9(b-a) |
| a |
| 9(b-a) |
| a |
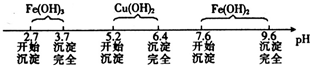
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
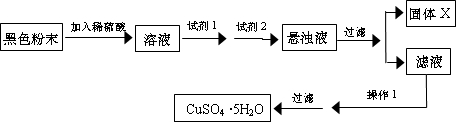
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ①C |
| 高温 |
| ②HCI |
| 300℃ |
| ③过量H2 |
| 1000~1100℃ |
| 物质 | SiHCl3 | SiCl4 | HCl |
| 沸点 | 33.0℃ | 57.6℃ | -84.7℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
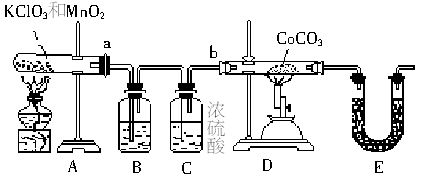
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com