
����Ŀ������ʵ�����������ͽ��۾���ȷ����
ѡ�� | ʵ����� | ʵ������ | ʵ����� |
A | �� | ��Һ��ɫ���� | ����������Ũ�ȣ�ƽ�� |
B | ���Ũ�� |
|
|
C | ȡ | ��Һ�г���ש��ɫ | ������ȫˮ�� |
D | �ֱ��� | ���� | ��Ӧ���Ũ��Խ��Ӧ����Խ�� |
A.AB.BC.CD.D

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��֪�����Ȼ�ѧ����ʽ��
��H2��g��+![]() O2��g���TH2O��l������H=-285.8kJmol-1
O2��g���TH2O��l������H=-285.8kJmol-1
��H2��g��+![]() O2��g���TH2O��g������H=-241.8kJmol-1
O2��g���TH2O��g������H=-241.8kJmol-1
��CO��g���TC��s��+![]() O2��g������H=+110.5kJmol-1
O2��g������H=+110.5kJmol-1
��C��s��+O2��g���TCO2��g������H=-393.5kJmol-1
�ش��������⣺
(1)������Ӧ�����ڷ��ȷ�Ӧ����_________________
(2)H2��ȼ������H=___________________
(3)ȼ��10gH2����Һ̬ˮ���ų�������Ϊ________________
(4)��ʾCOȼ���ȵ��Ȼ�ѧ����ʽΪ��________________
II��֪��(1)P4��s�����ף�+5O2(g)==P4O10��s����H1����2983��2kJ/mol
(2)P(s,����)+ ![]() O2(g)=
O2(g)= ![]() P4O10(s) ��H1����738.5kJ/mol,�����ת��Ϊ�����Ȼ�ѧ����ʽ_________________����ͬ��״���£������ϵ͵���_________________�������ȶ��ԱȺ���_________________����ߡ��͡���
P4O10(s) ��H1����738.5kJ/mol,�����ת��Ϊ�����Ȼ�ѧ����ʽ_________________����ͬ��״���£������ϵ͵���_________________�������ȶ��ԱȺ���_________________����ߡ��͡���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1915��ŵ��������ѧ������Henry Bragg��Lawrence Bragg���Ա���������X���߶Ծ���ṹ�ķ��������Ĺ��ף�
(1)��ѧ��ͨ��X����̽����NaCl��KCl��MgO��CaO����ṹ���ƣ��������־���ľ������������±���

4�־���NaCl��KCl��MgO��CaO�۵��ɸߵ��͵�˳����__��
(2)��ѧ��ͨ��X�����Ʋ���мȺ�����λ�����ֺ����������ṹʾ��ͼ�ɼ�ʾ���£�������λ����������������߱�ʾ��

��д����̬Cuԭ�ӵĺ�������Ų�ʽ__������ͭ��������__������ĸ���ţ��ѻ���ʽ��

��д������������ˮ��ͭ���ӵĽṹ��ʽ�����뽫��λ����ʾ������__��
��ˮ���Ӽ��������������о�������ʵ˵�������ˮ�����ʵ�Ӱ��__��
��SO42���Ŀռ乹����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڵ����仯����Ļ��������У����йط�Ӧ�ķ�Ӧԭ�������о�������Ҫ���塣
(1)t��ʱ������N2��NH3��������Ӧ����Ϣ���±���ʾ��
��ѧ��Ӧ | ����Ӧ��� | �淴Ӧ��� | t��ʱƽ�ⳣ�� |
N2(g)��O2(g)��2NO(g) ��H>0 | a kJ/mol | b kJ/mol | K1 |
4NH3(g)��5O2(g)��4NO(g)��6H2O(g) ��H<0 | c kJ/mol | d kJ/mol | K2 |
��д��t��ʱ������һ����������������������Ȼ�ѧ����ʽ��______________________��t��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ__________ (��K1��K2��ʾ)��
(2)��ҵ�ϳɰ���ԭ��Ϊ��N2(g)��3H2(g)![]() 2NH3(g)��ͼ�ױ�ʾ��һ��������ܱ������з�Ӧʱ��H2�����ʵ���Ũ����ʱ��ı仯��ͼ�ұ�ʾ�������������������£���ʼͶ��H2��N2�����ʵ���֮��(��Ϊx)��ƽ��ʱNH3�����ʵ��������Ĺ�ϵ��
2NH3(g)��ͼ�ױ�ʾ��һ��������ܱ������з�Ӧʱ��H2�����ʵ���Ũ����ʱ��ı仯��ͼ�ұ�ʾ�������������������£���ʼͶ��H2��N2�����ʵ���֮��(��Ϊx)��ƽ��ʱNH3�����ʵ��������Ĺ�ϵ��

��ͼ����0��t1 min�ڣ�v(N2)��_____mol��L��1��min��1��b���v(H2)��_____a���v(H2)��(������������С��������������)��
�ڼ�֪ij�¶��¸÷�Ӧ��ƽ��ʱ�����ʾ�Ϊ1 mol���������Ϊ1L�������¶Ⱥ�ѹǿ���䣬�ֳ���3 mol N2��ƽ��________(���������ƶ����������ƶ����������ƶ���)��
(3)����ѧ���о���������Ϊ������ȼ�ϵ���¼����������ֵ�ؿ�ֱ��ȥ�����з�ˮ�е����أ����ܲ���������ˮ�����ܷ��硣����ȼ�ϵ�ؽṹ��ͼ��ʾ��д�������缫��Ӧʽ��________________________________________________��
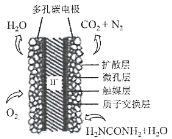
�������ϵ�ع���ʱ��ÿ���ı�״����2.24 L O2ʱ���ɲ����ĵ���Ϊ________ (�����ڳ���Ϊ96500C/ mol)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.2molij�л����0.5mol������һ�ܱ�������ȼ�յò���ΪCO2��CO��H2O(��)����������ͨ��Ũ����ʱ��Ũ���������������10.8g����ͨ�����ȵ�����ͭʱ������ͭ������������3.2g����ͨ����ʯ��ʱ����ʯ�ҵ�����������17.6g�����л���Ļ�ѧʽΪ�� ��
A.C2H4B.C2H6OC.C2H6O2D.C4H6O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ӫ������������ɫ��ӫ�ⳣ��������ָʾ�����������ڱ����������ͼ䱽���ӣ�����ˮ�Ȼ�п�����ºϳɵģ�����˵����ȷ���ǣ� ��
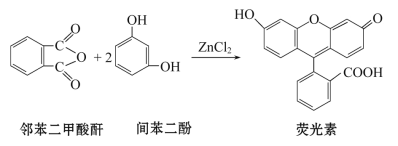
A.���������л�������ڷ�����
B.�ڱ���������������һ�ȴ��ﹲ��4��
C.1mol�䱽������������Ũ��ˮ��Ӧ���������4molBr2
D.������1molӫ����������NaOH��Һ��Ӧ���������2molNaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() �ǹ�ҵ�ϳ��õ�������֪
�ǹ�ҵ�ϳ��õ�������֪![]() ����Ԫ����
����Ԫ����![]() �ۣ������ȶ�����ˮ������᪻���Ӧ���������л��ܼ���ʵ���ҳ���
�ۣ������ȶ�����ˮ������᪻���Ӧ���������л��ܼ���ʵ���ҳ���![]() �봿���������Ʊ�
�봿���������Ʊ�![]() ����Ӧ�漰���ļ������ʵ��۷е����£�
����Ӧ�漰���ļ������ʵ��۷е����£�
���� |
|
|
|
|
�е� | 47 |
| 77 | 137 |
�۵� |
|
|
|
|
ʵ������������װ���Ʊ�![]() (���ּг���������ȥ)��
(���ּг���������ȥ)��
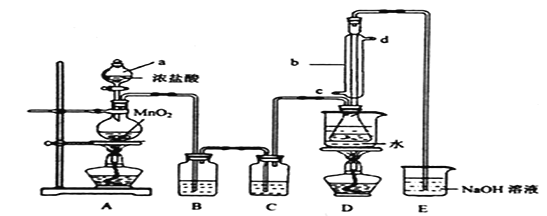
�ش��������⣺
(1)װ����b��������������Ϊ_________��д���Ʊ�![]() �Ļ�ѧ����ʽ_________��
�Ļ�ѧ����ʽ_________��
(2)D�в�����ˮԡ���ȵ�ԭ���� _________����Ӧ���������ƿ�ڻ�����з������Ʒ�ķ�����______��
(3)ʵ������У���ȱ��Cװ�ã����ֲ�Ʒ���Dz��壬���ָ������ԭ��ѧ����ʽ��ʾΪ______________��
(4)��ʵʼװ����ƴ���ȱ�ݣ���ĸĽ������� _________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ����ǻ�ѧ�������һ���ش��ס�
��(1).ij��ȤС��Ϊ�о�ԭ���ԭ���������ͼװ�á�a��b������ʱ���ձ��з�����Ӧ��������___________________________��
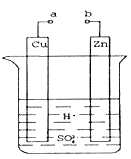
(2)a��b�õ������ӣ�Cu��Ϊԭ���___________ �������������������������缫��Ӧʽ��___________ ������__________������������������ԭ������Ӧ��
(3)��a��ֱ����Դ��������������Cu����ʯī�缫��b��ֱ����Դ�ĸ�����������ʯī�缫��Ӧʽ ______________________���ù��̵��ܷ�Ӧ����ʽΪ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D����Ԫ�����ڱ��еĶ�����Ԫ�أ����ǵĺ˵������������A��Ԫ�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ��ǽ���Ԫ��Bԭ�ӵĺ����������δ�ɶԵ�������3����Cԭ�ӵ������p����ĵ���Ϊ������ṹ��D�ǵؿ��к�������Ԫ�أ�Eλ�ڵ�4���ڣ����̬ԭ�ӵ��ڲ���ȫ���������ӣ���������������A��ͬ���ش��������⣺
��E�Ļ�̬ԭ�Ӽ۵����Ų�ͼ ______ ��
��B��C��D�ĵ�һ��������С�����˳��Ϊ ______ ��![]() ��Ԫ�ط��ű�ʾ
��Ԫ�ط��ű�ʾ![]()
��CA3��������ܶ����ͨ����λ����������ã�CA3���2�����е���һ��Ԫ�ص��⻯������õõ��Ļ�����X�ǿ�ѧ��DZ���о���һ�ִ���ԭ�ϣ�X������ĵȵ����壻����X�Ỻ���ͷ�H2��ת��Ϊ������Y��Y����ϩ�ĵȵ����塣
![]() ������CA3�ķ��ӿռ乹��Ϊ ______ ��X�ĽṹʽΪ ______
������CA3�ķ��ӿռ乹��Ϊ ______ ��X�ĽṹʽΪ ______ ![]() ���������λ��
����������![]() ��
��
![]() �γ�CA3���ʵ�����ԭ����X��Y�����е��ӻ���ʽ�ֱ��� ___��Y������������������Ŀ֮��Ϊ ____��
�γ�CA3���ʵ�����ԭ����X��Y�����е��ӻ���ʽ�ֱ��� ___��Y������������������Ŀ֮��Ϊ ____��
��E������±��(SCN)2��Ӧ����E(SCN)2����±��(SCN)2��Ӧ���������֣�������������(H��S��C![]() N)�ķе������������(H��N
N)�ķе������������(H��N![]() C
C![]() S)�ķе㣬��ԭ���� ______ ��
S)�ķе㣬��ԭ���� ______ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com