
下列说法正确的是
A. 用试管夹夹试管应从试管底往上套,拇指按在试管夹的短柄上
B. 装碘的试剂瓶中残留的碘可以用酒精洗涤
C. 配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用滴管滴加蒸馏水到刻度线
D. 定容时,俯视刻度线,会使所配溶液的浓度偏低
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源:2016-2017学年吉林长春十一高中等两校高一上期末化学卷(解析版) 题型:选择题
将3.2 g Cu跟30.0 mL 10.0 mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+,则此时溶液中含NO 的物质的量为 ( )
的物质的量为 ( )
A.0.5 a mol B.0.1 a mol C.(0.1+a) mol D.2 a mol
查看答案和解析>>
科目:高中化学 来源:2017届北京市西城区高三上学期期末考试化学试卷(解析版) 题型:选择题
废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH4+ 完全转化为N2,该反应可表示为2NH4+ + 3ClO-=N2 + 3Cl-+ 2H+ + 3H2O。下列说法中,不正确的是
A.反应中氮元素被氧化,氯元素被还原
B.还原性 NH4+ > Cl-
C.反应中每生成1 mol N2,转移6 mol电子
D.经此法处理过的废水可以直接排放
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高一上期末化学试卷(解析版) 题型:选择题
下列工业制法和生产中,说法正确的是
A.金属钠可以从四氯化钛溶液中置换出金属钛
B.工业制备和提纯硅的三步化学反应都是氧化还原反应
C.镁的提取中将氯化镁溶液蒸发结晶可直接获得无水氯化镁,电解熔融无水氯化镁得到金属镁
D.硫酸的工业制法中,依次使用的三种设备是沸腾炉,接触室,吸收塔
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高一上期末化学试卷(解析版) 题型:选择题
在某澄清透明的酸性溶液中,能共存的离子组是
A.NH4+、Cl-、Fe3+、K+ B.Na+、SO32-、K+、Cl-
C.MnO4-、Fe2+、Na+、SO42- D.K+、SO42-、HCO3-、Na+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高一上期末化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.木材、纺织品浸过水玻璃后,具有防腐性能且不易燃烧
B.金属镁的熔点高达2800℃,是优质的耐高温材料
C.氧化铁红颜料跟某些油料混合,可以制成防锈油漆
D.由于铜盐能杀死某些细菌,并能抑制藻类生长,因此游泳场馆常用硫酸铜作池水消毒剂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:实验题
实验室用下列方法测定某水样中O2的含量。

(1)用如上图所示装置,c是长橡胶管。使水中溶解的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为______________________。
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的________________。
②用注射器抽取20.00mL某水样从A处注入锥形瓶。
③再分别从A处注入含m mol NaOH的溶液及过量的MnSO4溶液。
④完成上述操作后,下面应进行的操作是___________。
A.微热锥形瓶 B.夹紧止水夹a、b C.充分振荡锥形瓶 D.继续通入N2
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O
⑤接着④操作后,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸溶液。
⑥重复第④步操作。
(3)用Na2S2O3标准溶液滴定(2)中生成的I2,反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6
⑦取下锥形瓶,向其中加入2~3滴__________作指示剂。
⑧用 0.005mol·L-1 Na2S2O3滴定至终点,终点现象_______________________。
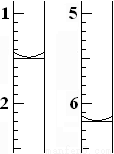
(4)滴定过程中,滴定前后滴定管中的液面读数如图所示。
⑨经计算,此水样中氧(O2)的含量为(单位:mg·L-1)_______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是

A. Z元素的最高价氧化物水化物的酸性强于Y
B. 由W元素形成的分子W2中存在三个共价键
C. 四种元素常见的氢化物:YH4、WH3、H2X、HZ中,YH4最稳定
D. 氢化物WH3与HZ反应生成的离子化合物中存在10e-、18 e-两种微粒
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:填空题
已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)等物质的量浓度的 A.CH3COONa、B.NaCN、C.Na2CO3、D.NaHCO3溶液的pH由大到小的顺序为____________(填字母)。
(2)常温下, 0.1 mol·L-1的CH3COOH 溶液加水稀释,下列表达式的数据变大的是______。
A.C(H+) B.C(H+)/C(CH3COOH) C.C(H+)·C(OH-)
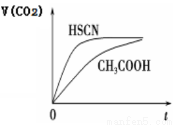
(3)25 ℃时,将 20 mL 0.1 mol·L-1 CH3COOH 溶液和 20mL0.1 mol·L-1HSCN溶液分别与20mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如右图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是____________; 反应结束后所得两溶液中,(CH3COO-)________c(SCN-)(填“>”、 “<”或“=”)
(4)25 ℃时,在 CH3COOH 与 CH3COONa 的混合溶液中,若测得 pH=6,则溶液中c(CH3COO-)-c(Na+)=__________mol·L-1(填精确值), c(CH3COO-)/c(CH3COOH)=_________。
(5)用离子方程式表示Na2CO3溶液呈碱性的原因_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com