
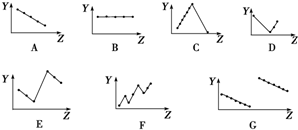
分析 (1)同一主族元素价电子数相等,与原子序数无关;
(2)第三周期元素的最高正化合价随着原子序数增大而增大,稀有气体除外;
(3)IA族金属元素单质熔点随着原子序数增大而减小;
(4)电子层数越多,离子半径越大,电子层结构相同的离子其离子半径随着原子序数增大而减小;
(5)电子层数越大其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小.
解答 解:(1)同一主族元素价电子数相等,与原子序数无关,第IIA族元素价电子数都是2,故答案为:B;
(2)第三周期元素的最高正化合价随着原子序数增大而增大,稀有气体除外,所以化合价从+1升高到+7,稀有气体为0价,C符合;
故答案为:C;
(3)IA族金属元素单质的熔点与其原子半径成反比,所以碱金属族单质的熔点随着原子序数增大而减小,
故答案为:A;
(4)电子层数越多,离子半径越大,电子层结构相同的离子其离子半径随着原子序数增大而减小,则Na+、Mg2+、Al3+的离子半径依次减小,P3-、S2-、Cl-的离子半径依次减小,阴离子半径大于阳离子半径,
故答案为:E;
(5)部分短周期元素的原子半径,电子层数越大其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,故G符合,
故答案为:G.
点评 本题考查原子结构和元素性质,侧重考查元素周期律,熟练掌握同一周期、同一主族元素性质变化规律,并灵活运用这些规律解题,注意规律中的异常现象,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 都正确 | B. | ①②③ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、SO42-、CO32- | B. | Na+、Ca2+、SO42-、NO3- | ||
| C. | Ag+、Mg2+、Cl-、S2- | D. | Na+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
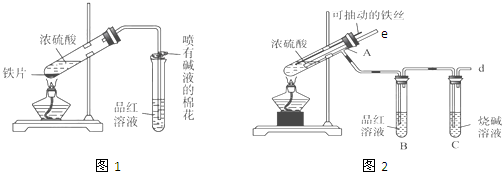
| 实验步骤 | 实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 | (1)如果没有观察到溶液颜色有明显变化,则说明Ⅱ成立. (2)如果观察到溶液颜色转化为红色,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立. |
| 2、 另取一支洁净的试管,加1-2mL试样溶液,用胶头滴管逐滴滴加酸性高锰酸钾溶液 | 如果滴加酸性高锰酸钾溶液后溶液的紫红色褪色,则说明溶液中含有亚铁离子,说明Ⅲ成立;如果滴加酸性高锰酸钾溶液后溶液紫红色不褪,则说明溶液中没有亚铁离子,说明Ⅰ成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
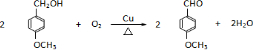
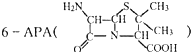 是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如图:
是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如图:
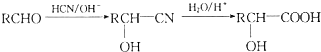
 .
. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com