
【化学一选修3:物质结构与性质】X、Y、Z、W四种元素的部分信息如下表所示。
元素 | X | Y | Z | W |
相关 信息 | 短周期元素,最高化合价为 +7价 | 基态原子中,电子占据的最高能层符号为L,最高 能级上只有两个自旋方向相同的电子 | 核外电子共有15种运动状态 | 能与X形成两种常见化合物WX2、WX3,酚遇WX3溶液能发生显色反应 |
回答下列问题:
(1) W的基态原子电子排布式为____, X、Y、Z三种元素电负性由大到小的顺序为___(用具体的元素符号填写)。
(2)化合物YX4、ZX3、ZX5 (气态或液态时)中,中心原子的轨道类型不是sp3杂化的是________(填化学式,下同),分子构型是正四面体的是______, 属于极性分子的是____。
(3)已知WX3的熔点:306℃,沸点:319℃,则WX3的晶体类型为____,Y与氢元素能形成YnH2n+2 (n为正整数)的一系列物质,这一系列物质沸点的变化规律以及影响的因素是______________。
(4)Z可形成多种含氧酸,如H3ZO4、HZO3、H3ZO3等,其中酸性最强的是______(填化学式)。
(5)W元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。在面心立方晶胞中W原子的配位数为___;若W的原子半径为r cm,阿伏加德罗常数为NA,则其体心立方晶体的密度可表示为_____g•cm-3。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高一下学期开学检测化学试卷(解析版) 题型:选择题
下列气体不能用浓硫酸干燥的是( )
A. NH3 B. SO2 C. Cl2 D. HCl
查看答案和解析>>
科目:高中化学 来源:湖南省长沙市2016-2017学年高一上学期期末考试化学试卷 题型:填空题
化学与人类生活密切相关。请按要求,回答下列问题:
(1)酸雨的pH小于______________。
(2)漂白粉有效成分的化学式为______________,其能消毒杀菌是因有强_________性。
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为_____________。
⑷KA1(SO4)2 • 12H2O的俗名为_________,因其溶于水生成______________(化学式)而具有净水作用。
(5)向一铝制易拉罐中充满CO2后,再往罐中注入足量的质量分数为20%的NaOH溶液,立即严封罐口,不—会儿就发现易拉罐变瘪,再过一会易拉罐又鼓胀起来,解释上述实验现象,易拉罐又鼓胀起来的原因是________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三高考适应性月考(六)理综化学试卷(解析版) 题型:填空题
[化学-选修3:物质结构与性质]
硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是_________________。
(2)①硫单质的一种结构为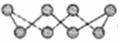 ,杂化方式为______________,该物质___________(填“可溶”或“难溶”)于水,该晶体中存在的作用力___________、_____________。
,杂化方式为______________,该物质___________(填“可溶”或“难溶”)于水,该晶体中存在的作用力___________、_____________。
②SO42-、CS2、CO32-键角由大到小的顺序是_________________。
(3)含硫的物质的特殊性质与其结构相关。
①熔点:SF6 _______A1F3(填“>”或“<”),原因是___________________。
②分析并比较 与
与 的沸点高低:___________________。
的沸点高低:___________________。
(4)ZnS晶胞如图所示:
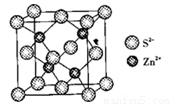
①由图可知,Zn2+填在了S2-形成的______________空隙中。
②已知晶胞密度为, g/cm3,阿伏加德罗常数为NA,则晶胞边长为__________pm。
g/cm3,阿伏加德罗常数为NA,则晶胞边长为__________pm。
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三高考适应性月考(六)理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 标况下,将5.6g铁片投入足量浓硝酸中生成6.72L NO2气体
B. lmol FeBr2与1.2mol Cl2反应转移的电子数为2. 4mol
C. 1. 0L 1.0mol·L-1的草酸溶液中含有的H+数为2NA
D. 23g乙醇中存在的共价键总数为7NA
查看答案和解析>>
科目:高中化学 来源:2017届云南省昆明市新课标高三月考卷(六)理综化学试卷(解析版) 题型:选择题
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图所示。下列有关说法正确的是
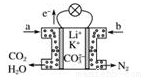
A. a为空气,b为CH4
B. CO32-向正极移动,K+、Li+向负极移动
C. 负极电极反应式为CH4-8e-+4CO32-=5CO2+2H2O
D. 正极电极反应式为O2+4e-+2H2O=4OH
查看答案和解析>>
科目:高中化学 来源:2017届福建省晋江市等四校高三第二次联合考试理综化学试卷(解析版) 题型:简答题
[化学—选修3:物质结构与性质]
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4。回答下列问题:
⑴写出基态Zn原子的价电子排布式__________,基态S原子核外未成对电子数为_____。
⑵ZnSO4中三种元素的电负性由大到小的顺序为_____________________,SO42-的立体构型为________________,其中S的杂化轨道类型为_________。
⑶硫酸锌溶于氨水可生成[Zn(NH3)4]SO4溶液,[Zn(NH3)4]SO4溶液中不存在的微粒间作用力有___________。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
⑷根据下列锌卤化物的熔点和溶解性,判断ZnF2晶体的类型为___________;分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因________________。
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
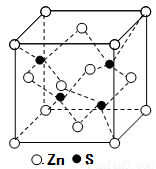
⑸立方ZnS晶体的密度为ρg·cm-3,其晶胞结构如图。S2-周围等距离且最近的Zn2+、S2-依次为______、______;ZnS晶胞中的晶胞参数a=________nm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
0.5mol某气态烃能与1molHCl发生加成反应,生成氯代烷,0.5mol此氯代烷可与3mol氯气发生完全的取代反应,则该烃可能为
A. 乙烯 B. 丙烯 C. 乙炔 D. 丙炔
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、溧水高级中学)等六校高三2月联考化学试卷(解析版) 题型:填空题
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解。
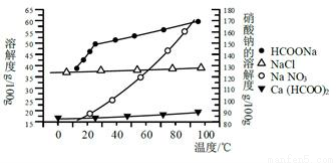
Ⅰ、实验室制取的方法之一是:Ca(OH)2 +2HCHO + H2O2 = Ca(HCOO)2 + 2H2O + H2↑。实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1∶2∶1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品。
(1)过氧化氢比理论用量稍多,其目的是__________。
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是__________。
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是__________。
(4)实验时需强力搅拌45min,其目的是__________;结束后需调节溶液的pH 7~8,其目的是__________。最后经结晶分离、干燥得产品。
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算),现提供的试剂有:A.甲酸钠,B.5mol·L-1硝酸,c.5mol·L-1盐酸,d.5mol·L-1硫酸,e.3%H2O2溶液,f.澄清石灰水。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
请补充完整由碳酸钙制备甲酸钙的实验步骤 :
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶待用,并称取研细的碳酸钙样品10g待用。
步骤2._________。
步骤3._________。
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、__________、洗涤、60℃时干燥得甲酸钙晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com