
NA为阿伏伽德罗常数,下列说法不正确的是
A.常温常压下,28gCO和N2混合气体中含有的原子总数为2
B.标准状况下,11.2L的水中含有水分子0.5NA
C.2molOH-中电子数为20NA
D.0.1molFeCl3形成Fe(OH)3胶体,Fe(OH)3胶粒的数目小于0.1
科目:高中化学 来源:2016-2017学年河北石家庄一中高二上期中考试化学试卷(解析版) 题型:选择题
下列物质的沸点由高到低排列的是
①CH3(CH2)2CH3
②CH3(CH2)3CH3
③(CH3)3CH
④(CH3)2CHCH2CH3.
A.④②①③
B.②④①③
C.④①②③
D.②④③①
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃静宁一中高一上月考二化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是
A.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
B.氢氧化钡与硫酸反应:OH-+H+=H2O
C.铜片插入硝酸银溶液中发生反应:Cu+Ag+=Cu2++Ag
D.氯化镁溶液与氢氧化钠溶液发生反应:Mg2++2OH-=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽铜陵市高一上期中考试化学试卷(解析版) 题型:填空题
按要求完成下列5小题
(1)用澄清的石灰水检验CO2气体的离子方程式:
(2)向NaHSO4溶液中逐滴加入Ba(OH)2,刚好呈中性时离子方程式:
(3)醋酸和氨水反应的离子方程式:
(4)Cu2++Fe=Fe2++Cu相应的化学方程式:
(5)硫酸铁在水中的电离方程式:
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽铜陵市高一上期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.分离Br2和CCl4的混合物,用分液漏斗进行分液
B.500mL0.5mol/L的Al2(SO4)3溶液,取出50mL,其中SO42-浓度为1.5mol/L
C.蒸发时,应使混合物中的水分完全蒸干后,才能停止加热
D.分液时,分液漏斗中下层液体从下口放出,上层液体从下口放到另一个烧杯
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽铜陵市高一上期中考试化学试卷(解析版) 题型:选择题
固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是

查看答案和解析>>
科目:高中化学 来源:2017届江苏省、六合等七校高三上期中化学试卷(解析版) 题型:填空题
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下,回答下列问题:
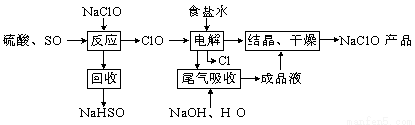
(1)ClO2的沸点为283K,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下更安全。写出“反应”步骤中生成ClO2的化学方程式 。
(2)“尾气吸收”是吸收“电解”过程排出的少量ClO2。
①在尾气吸收过程中,可代替H2O2的试剂是 (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
②提高尾气的吸收效率的可行措施有 (填序号)。
A.尾气吸收时充分搅拌吸收液 B.适当加快尾气的通入速率
C.将温度控制在20℃以下 D.加水稀释尾气吸收液
③此吸收反应中,氧化剂与还原剂的物质的量之比为 。
(3)在碱性溶液中NaClO2比较稳定,在酸性溶液中,ClO2-和H+结合为HClO2,HClO2是唯一的亚卤酸,不稳定,易分解产生Cl2、ClO2和H2O,写出HClO2分解的化学方程式: 。
(4)已知NaClO2的溶解度随温度升高而增大,NaClO2饱和溶液在38℃以上60℃以下会析出NaClO2,在NaClO2析出过程中可能混有的杂质是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2017届广东省韶关市六校高三上10月联考化学试卷(解析版) 题型:推断题
[化学——选修3:物质结构与性质]周期表前三周期元素A、B、C、D,原子序数依次增大,A的基态原子的L层电子是K层电子的两倍;B的价电子层中的未成对电子有3个;C与B同族;D的最高价含氧酸为酸性最强的无机含氧酸。请回答下列问题:
(1)C的基态原子的电子排布式为____________________;D的最高价含氧酸酸性比其低两价的含氧酸酸性强的原因是____________________。
(2)杂化轨道分为等性和不等性杂化,不等性杂化时在杂化轨道中有不参加成键的孤电子对的存在。A、B、C都能与D形成中心原子杂化方式为____________的两元共价化合物。其中,属于不等性杂化的是______________(写化学式)。以上不等性杂化的化合物价层电子对立体构型为___________,分子立体构型为__________________。
(3)以上不等性杂化化合物成键轨道的夹角___________(填“大于”、“等于”或“小于”)等性杂化的化合物成键轨道间的夹角。由于C核外比 B多一层电子,C还可以和D形成另一种两元共价化合物。此时C的杂化轨道中没有孤对电子,比起之前C和D的化合物,它的杂化轨道多了一条。其杂化方式为_______________。
(4)A和B能形成多种结构的晶体。其中一种类似金刚石的结构,硬度比金刚石还大,是一种新型的超硬材料。其结构如下图所示(图1为晶体结构,图2为切片层状结构),其化学式为____________。实验测得此晶体结构属于六方晶系,晶胞结构见图3。已知图示原子都包含在晶胞内,晶胞参数a=0.64 nm,c=0.24 nm。其晶体密度为_____________(已知:a=0.64 nm,c=0.24 nm, 结果精确到小数点后第2位
图1 A和B形成的一种晶体结构图 图2 切片层状结构 图3 晶胞结构
(图2和图3中:○为N原子、●为C原子)
查看答案和解析>>
科目:高中化学 来源:贵州省铜仁市2016-2017学年高一上期中化学试卷(解析版) 题型:实验题
某工厂的工业废水中含有大量的Fe2+、Cu2+、SO42-和Na+,为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁及金属铜,请根据下列流程在标有①﹣⑤的方框和括号内填写物质名称或操作方法,完成回收硫酸亚铁及金属铜的简单实验方案。

请完成流程图空白:
① 。② 。
③ 和 。④ 。
⑤ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com