
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 由水电离的H+离子浓度等于10﹣12mol/L的溶液中:Na+、K+、NO3﹣、HCO3﹣
B. pH=1的溶液中:Fe2+、NO3﹣、SO42﹣、Na+
C. 加酚酞呈红色的溶液中:CO32﹣、Cl﹣、F﹣、NH4+
D. c(H+)/C(OH﹣)=1012的溶液中:NH4+、NO3﹣、Cl﹣、Fe3+
科目:高中化学 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:选择题
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
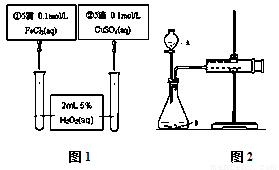
A. 图1实验可通过观察产生气泡快慢来比较反应速率的大小
B. 若图1所示实验中反应速率为①>②, 则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C. 用图2装置测定反应速率,可测定反应产生的气体体积及反应时间
D. 为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省庄河市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量稀盐酸,固体全部溶解;再加入过量烧碱溶液,有白色沉淀产生;
②取少量样品加入足量水,固体全部溶解;再加入稀硫酸,有白色沉淀产生。
该白色粉末可能为
A. BaCl2、Al(NO3)3 B. BaCO3、MgCl2
C. MgSO4、AlCl3 D. Ba(NO3)2、Mg(NO3)2
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:选择题
化学与生产生活密切相关,下列物质的用途及解释均正确的是
选项 | 用途 | 解释 |
A | 可用FeCl3溶液刻蚀铜制电路板 | Fe3+的氧化性强于Cu2+ |
B | 碳与石英反应可冶炼粗硅 | 碳的非金属性比硅强 |
C | 四氯化碳可用于灭火 | 四氯化碳的沸点高 |
D | 酸性KMnO4溶 液可漂白织物 | KMnO4有强氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试(寒假作业检测)化学试卷(解析版) 题型:选择题
一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试(寒假作业检测)化学试卷(解析版) 题型:选择题
铜锌原电池(如图)工作时,下列叙述正确的是( )

A. 在外电路中,电流从Zn极流向Cu极
B. 盐桥中的Cl﹣移向CuSO4溶液
C. 当负极减小65g时,正极增加65g
D. 电池的总反应为 Zn+Cu2+=Zn2++Cu
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省景德镇市高二(素质班)上学期期末考试化学试卷(解析版) 题型:实验题
肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4 H2O):
H2O):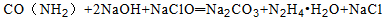
NaClO过量时,易发生反应:
实验一:制备NaClO溶液(实验装置如图甲所示)
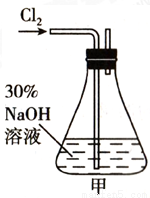
锥形瓶中发生反应的离子方程式是__________________。
实验二:制取水合肼(实验装置如图乙所示)
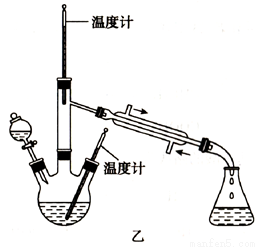
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114℃馏分。
分液漏斗中的溶液是_____________(填序号);
A、CO(NH2)2溶液 B、NaOH溶液 C、NaOH和CO(NH2)2混合溶液 D、NaOH和NaClO混合溶液
选择的理由是_________________。
实验三:测定馏分中肼含量
称取馏分5.000g加入适量NaHCO3固体,加入配成250mL溶液,移出25.00mL,用0.1000mol/L的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右(已知:N2H4 H2O+2I2═N2↑+4HI+H2O)。
H2O+2I2═N2↑+4HI+H2O)。
配制250mL溶液所需仪器除分析天平、烧杯、玻璃棒外,还需______________。
滴定过程中,NaHCO3能控制溶液的pH在6.5左右,用离子方程式解释其原因:__________。
实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4 H2O)的质量分数为____________。
H2O)的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:计算题
将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
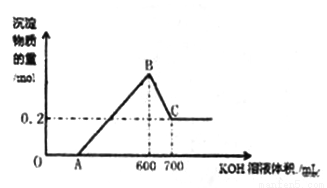
(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:填空题
硫酸工业中,作为催化剂的V2O5对反应I的催化循环过程经历了Ⅱ、Ⅲ两个反应阶段,图示如下:

(1)下列分子中1mol化学键断裂时需要吸收的能量数据如下:
化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
能量/kJ | 535 | 472 | 496 |
则反应I的△H=_______kJ/mol。反应Ⅲ的化学方程式为__________________。
(2)从废钒催化剂中回收V2O5的过程如下:

①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式_________。
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为________[25℃,Ksp(NH4VO3) =1.6×10-3,溶液体积变化忽略不计]。
(3)采用脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。
①向此溶液稀溶液中再加入少量(NH4)2SO4固体,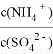 将_______(填“变大”、“不变”或“变小”)。
将_______(填“变大”、“不变”或“变小”)。
②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则 =_______(用含a的代数式表示,NH3·H2O的Kb=1.7×10-5)
=_______(用含a的代数式表示,NH3·H2O的Kb=1.7×10-5)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com