
【题目】NA代表阿伏加德罗常数的值。下列说法错误的是( )
A.密闭容器中,2molSO2和1molO2催化反应后分子总数大于2NA
B.1LpH=2的H2SO3溶液中含H+的数目为0.01NA
C.5.6g铁与稀硝酸反应生成0.08molNO,转移电子数为0.3NA
D.6.4 g S2和S8的混合物中所含硫原子数为0.2 NA
【答案】C
【解析】
A.若2molSO2和1molO2完全反应,可生成2molSO3,即反应后分子总数为2NA,但实际上该反应是可逆反应,不能完全进行,故反应后分子总数大于2NA,故A正确;
B.pH=2的H2SO3溶液中c(H+)=0.01mol/L,溶液体积为1L,所以溶液中所含氢离子数目为0.01NA,故B正确;
C.该过程中还原产物为NO,氮元素由+5价变为+2价,所以生成一个NO,转移3个电子,则生成0.08molNO转移电子数为0.24NA,故C错误;
D.6.4 g S2和S8的混合物即6.4gS原子,所以硫原子的数目为![]() ×NAmol-1=0.2NA,故D正确;
×NAmol-1=0.2NA,故D正确;
故答案为C。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】目前,国家电投集团正在建设国内首座百千瓦级铁-铬液流电池储能示范电站。铁-铬液流电池总反应为Fe2+ + Cr3+![]() Fe3 + + Cr2+,工作示意图如图。下列说法错误的是
Fe3 + + Cr2+,工作示意图如图。下列说法错误的是
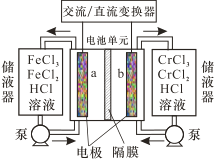
A.放电时a电极反应为 Fe 3++e- =Fe2+
B.充电时b电极反应为 Cr3++e- =Cr2+
C.放电过程中H+通过隔膜从正极区移向负极区
D.该电池无爆炸可能,安全性高,毒性和腐蚀性相对较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下合成甲醇的反应为;CO(g)+2H2(g)![]() CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是
CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是
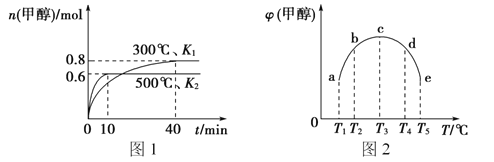
A. 该反应的△H1>0,且K1>K2
B. 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压
C. 300℃时,向平衡后的容器中再充入0.8molCO, 0.6molH2,0.2molCH3OH,平衡正向移动
D. 500℃时,向平衡后的容器中再充入1molCH3OH,重新平衡后,H2浓度和百分含量均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法正确的是( )

A.原子半径:W>Z
B.常温下,X的单质与Y的单质均能溶于浓硫酸
C.X的最高价氧化物的水化物是强碱
D.最简单气态氢化物热稳定性:Z<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6![]() 2CH3CH2OH+2CO2↑)。
2CH3CH2OH+2CO2↑)。
Ⅰ.已知:实验室制乙烯原理为CH3CH2OH![]() CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:

操作 | 现象 |
点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)溶液“渐渐变黑”,说明浓硫酸具有___性。
(2)对产生的气体进行分析,甲认为是C2H4,乙认为不能排除SO2的作用。
①写出实验室制取SO2的化学反应方程式是___;
②乙根据现象认为实验中产生的SO2和___,使B中有色物质反应褪色。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色。
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)
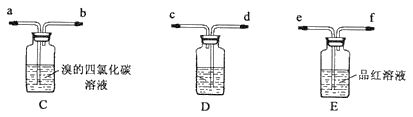
现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色。
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是___;乙设计的实验D中盛放的试剂是___,装置连接顺序为___ (用仪器接口字母编号)。
b.能说明确实是SO2使E中溶液褪色的实验是___。
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是___。由此可得出的干燥的SO2不能使Br2的四氯化碳溶液褪色。
Ⅱ.葡萄酒中常用Na2S2O5做抗氧化剂。
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。写出Na2S2O5溶于水时溶液中离子浓度由大到小的排列顺序___。
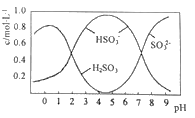
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述错误的是( )
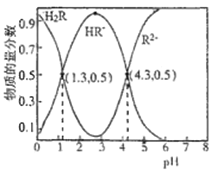
A.在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-)
B.等体积、等浓度的NaOH溶液与H2R溶液混合后,此溶液中水的电离程度比纯水小
C.在pH=3的溶液中存在![]() =10-3
=10-3
D.向Na2CO3溶液中加入少量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制备和研究乙炔性质的实验装置图。下列说法不正确的是
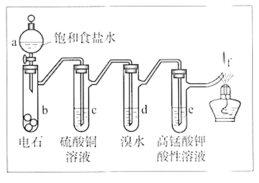
A.制备乙炔的反应原理是CaC2+2H2O→Ca(OH)2+C2H2↑
B.c的作用是除去影响后续实验的杂质
C.e中的现象说明乙炔能被高锰酸钾酸性溶液氧化
D.f处观察到的现象是安静燃烧,火焰呈淡蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对应下列叙述的微粒M和N,肯定属于同主族元素且化学性质相似的是( )
A.原子核外电子排布式:M为1s22s2,N为1s2
B.结构示意图:M![]() ,N
,N![]()
C.M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D.M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中关于能量的比较正确的是( )
①CH3OH(g)+O2(g)=CO (g)+2H2O(l) △H1;CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H2; △H1<△H2
②2H2O(l) =2H2(g)+O2(g) △H1; 2Na(s)+2H2O(l) =2NaOH(aq)+H2(g) ΔH2; △H1>△H2
③H2(g)+Cl2(g)=2HCl(g) △H1; ![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl (g) △H2; △H1>△H2
Cl2(g)=HCl (g) △H2; △H1>△H2
④t ℃时,在一定条件下,将 1 mol N2和 3 mol H2 分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为 Q1、Q2 ; Q1<Q2
A.①③B.②④C.③④D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com