
下列有关说法正确的是
A. 向鸡蛋清的溶液中加入饱和硫酸钠溶液,鸡蛋清因发生变性而沉淀析出
B. 溶液和胶体的鉴别可利用丁达尔效应
C. 进行焰色反应时,铂丝需用稀硫酸洗净,并在火焰上灼烧至无色
D. 水晶和陶瓷的主要成分都是硅酸盐
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:2017届吉林省高三第五次模拟化学卷(解析版) 题型:选择题
醇(C5H12O)发生下列反应时,所得产物数目最少(不考虑立体异构)的是
A.与金属钠置换 B.与浓硫酸共热消去
C.铜催化下氧化 D.与戊酸酯化
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省牡丹江市高三2月开学检测理综化学试卷(解析版) 题型:实验题
工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:
实验一:高温分解FeSO4,利用如图所示的实验装置进行实验。
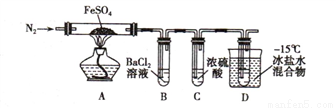
已知:①SO2熔点为-72℃,沸点为-10℃ ② SO3熔点为-16.8℃,沸点为44.8℃
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是_________________________
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为_________色,写出该反应的化学方程式___________________。
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是__________________, 将反应后所得溶液滴入D试管中,溶液变为浅绿色,该反应的离子方程式是 _______________
实验二 探究高温分解 FeSO4生成的气体
(4)用如图所示装置设计实验,验证高温分解FeSO4生成的气态物质
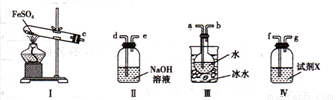
①按气流方向连接各仪器,用字母表示接口的连接顺序:c-__________________________
②试剂X的名称是 ___________________________
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的FeSO4 的质量,向圆底烧瓶中逐渐滴入氯化钡溶液,直到沉淀完全;然后过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。若最终得到沉淀的质量为Wg ,则已分解的FeSO4的质量 ________________g。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三下学期期初联考化学试卷(解析版) 题型:选择题
现有下列三个氧化还原反应:
① 2B- + Z2 = B2+2 Z - ② 2A2+ + B2 = 2A3+ + 2B- ③ 2XO4- + 10Z - + 16H+ = 2X2+ + 5Z2 + 8H2O
根据上述反应,判断下列结论中错误的是
A. 要除去含有 A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入Z2
B. 还原性强弱顺序为: A2+﹥B-﹥Z-﹥X2+
C. X2+是 XO4- 的还原产物, B2 是 B-的氧化产物
D. 在溶液中可能发生反应: XO4- +5 A2++ 8H+ = X2+ + 5A3+ + 4H2O
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三下学期期初联考化学试卷(解析版) 题型:选择题
已知 X、Y、Z、R、W均为短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15; X与 Z可形成XZ2分子, Y与 R形成的气态化合物在标准状况下的密度为 0.76g·L-1,W是短周期中金属性最强的元素。下列说法正确的是
A. W与Z只能形成阴、阳离子数之比为 1:2 的化合物
B. 原子半径大小顺序: W﹥Z﹥Y﹥X
C. X 能形成多种单质,且均为原子晶体
D. X、Y、Z均能形成最高价氧化物的水化物,且酸性逐渐增强
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三下学期期初联考化学试卷(解析版) 题型:选择题
下列有关物质的用途不正确的是
A. 高纯度的单质硅可用于制作计算机芯片 B. 钠钾合金可在快中子反应堆中作热交换剂
C. 二氧化硫不可用作熏蒸粉丝 D. 碳酸钠可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三下学期第一次联考理综化学试卷(解析版) 题型:简答题
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子效的3倍。X、Y和Z分属不同的周期,它们的原子序教之和是W 原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二元化合物中.由元素W与Y形成的化合物M的熔点最高。
请回答下列问题:
(1)W元素原子的L层电子排布式为__________,W3分子的空间构型为______;
(2)X单质与水发生主要反应的化学方程式为_____________;
(3)化合物M的化学式为_______,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是_________。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有___________,O-C-O的键角约为_______;
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X:Y:Z=___________;
(5)含有元素Z的盐的焰色反应为_____色。许多金属盐都可以发生焰色反应,其原因是_________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市高二下学期开学考试化学试卷(解析版) 题型:选择题
室温下向饱和AgCl溶液中加水,下列叙述正确的是
A. AgCl的溶解度增大 B. AgCl的溶解度、Ksp均不变
C. AgCl的Ksp增大 D. AgCl的溶解度、Ksp均增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省六安市高一上学期期末考试化学试卷(解析版) 题型:选择题
用NA代表阿伏加德罗常数,下列说法正确的是( )
A. 相同质量的铝,分别与足量的盐酸和氢氧化钠溶液反应放出的氢气体积一定不相同
B. 56gFe与足量盐酸反应转移电子数为3NA
C. 任何条件下,22.4LNH3与18gH2O所含电子数均为10NA
D. 46gNO2和N2O4的混合物含有的原子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com