
| A.Na,Mg,Al | B.Na,K,Zn,Fe |
| C.Zn,Fe,Cu,Ag | D.Mg,Al,Zn,Fe |
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+ |
| B.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含有Cu2+和Fe3+ |
| C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+ |
| D.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀 完全时的pH |
| Fe3+ Fe2+ | 1.9 7.0 | 3.2 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2Cu+SO2
2Cu+SO2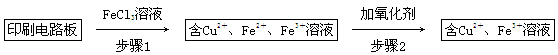
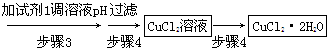
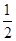 O2(g)=H2O(l) ΔH3=-286 kJ·mol-1
O2(g)=H2O(l) ΔH3=-286 kJ·mol-1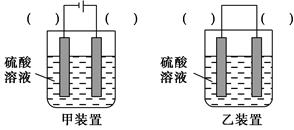
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
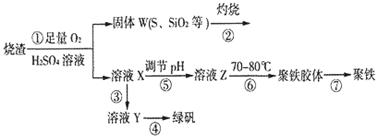
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.冶炼钢铁常采用热分解法 |
| B.Q460是含铁、碳、硅、锰、硫、磷等元素的合金钢,其中铁和锰不属于主族元素 |
| C.铝热法炼铁的反应需要高温的条件,所以是吸热反应 |
| D.增加炼铁高炉的高度可以减少尾气CO的排放 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
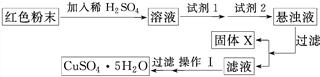
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 操作、现象 | 解释 |
| A | 向KI-淀粉溶液中加入FeCl3溶液,溶液变蓝 | Fe3+能与淀粉发生显色反应 |
| B | 把生铁放置于潮湿的空气中,铁表面有一层红棕色的斑点 | 铁在潮湿的空气中易生成Fe(OH)3 |
| C | 向稀硝酸中加入少量铁粉,有气泡产生 | 说明Fe置换出硝酸中的氢,生成了氢气 |
| D | 新制Fe(OH)2露置于空气中一段时间,白色物质变成了红褐色 | 说明Fe(OH)2易被O2氧化成Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com